题目内容
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A、MgO、Al2O3、SO2、CO2 |
| B、CO2、Cl2、CaO、SO3 |
| C、Cl2、Al2O3、N2O3、SO3 |
| D、SiO2、N2O5、CO、Cl2 |
考点:镁、铝的重要化合物,氯气的化学性质,硅和二氧化硅,钠的重要化合物
专题:元素及其化合物
分析:酸性氧化物和过量氢氧化钠溶液反应生成正盐,氯气和氢氧化钠溶液反应生成钠盐,铝、铝离子和足量氢氧化钠溶液反应生成偏铝酸钠,以此来解答.
解答:
解:A.Al2O3、SO2、CO2分别与足量NaOH反应,生成偏铝酸钠、亚硫酸钠、碳酸钠,共3种盐,而MgO不与NaOH反应;
B.CO2、Cl2、SO3分别与足量NaOH反应,生成碳酸钠、氯化钠、次氯酸钠、硫酸钠,共4种盐,而CaO不与NaOH反应;
C.C12与足量NaOH溶液反应生成的盐为氯化钠和次氯酸钠;Al2O3与足量NaOH生成偏铝酸钠;N2O3与足量NaOH溶液反应生成的盐为亚硝酸钠;SO3与过量NaOH溶液反应生成的盐为硫酸钠,共5种盐;
D.SiO2、N2O5、Cl2分别与足量NaOH反应生成硅酸钠、硝酸钠、NaCl和NaClO,共4种盐,而CO不与NaOH反应;
故选C.
B.CO2、Cl2、SO3分别与足量NaOH反应,生成碳酸钠、氯化钠、次氯酸钠、硫酸钠,共4种盐,而CaO不与NaOH反应;
C.C12与足量NaOH溶液反应生成的盐为氯化钠和次氯酸钠;Al2O3与足量NaOH生成偏铝酸钠;N2O3与足量NaOH溶液反应生成的盐为亚硝酸钠;SO3与过量NaOH溶液反应生成的盐为硫酸钠,共5种盐;
D.SiO2、N2O5、Cl2分别与足量NaOH反应生成硅酸钠、硝酸钠、NaCl和NaClO,共4种盐,而CO不与NaOH反应;
故选C.
点评:本题考查物质的性质,综合考查元素化合物知识,把握物质的性质及发生的化学反应为解答的关键,侧重氯气、铝的化合物及酸性氧化物性质的考查,题目难度不大.

练习册系列答案
相关题目
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、O2和O3共32 g混合物中氧原子的个数为2NA |
| B、78 g苯含有C═C 键的数目为3NA |
| C、1 mol Na2O2固体中含离子总数为4NA |
| D、足量Fe与1 mol 氯气反应时转移的电子数为3NA |
下列说法错误的是( )
| A、“血液透析”利用了胶体的性质 |
| B、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
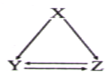 下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )

 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示: