题目内容
据统计世界锂离子电池用量极大,对不可再生的金属资源的消耗是相当大的.因此锂离子电池回收意义重大,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂.某回收工艺流程如下:

(1)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 .
(2)碱浸时主要反应的离子方程式为 .
(3)酸浸时反应的化学方程式为 .酸浸以后,过滤伴随着用蒸馏水洗涤沉淀,洗涤沉淀的操作方法是: .
(4)已知Li2CO3在水中的溶解度随着温度升高而减小.加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 .
(5)对Li2CO3沉淀进行如下处理可以获取锂单质:
①LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂.电解时产生的氯气中混有少量氧气,产生氧气的原因是 .
②由锂单质制作摇摆电池,其工作原理如图所示,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为LiCoO2+6C
Li(1-x)CoO2+LixC6.则当电池消耗 72g C,B极失去 mol电子.


(1)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是
(2)碱浸时主要反应的离子方程式为
(3)酸浸时反应的化学方程式为
(4)已知Li2CO3在水中的溶解度随着温度升高而减小.加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
(5)对Li2CO3沉淀进行如下处理可以获取锂单质:

①LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂.电解时产生的氯气中混有少量氧气,产生氧气的原因是
②由锂单质制作摇摆电池,其工作原理如图所示,在充放电过程中,Li+在两极之间“摇来摇去”,其总反应为LiCoO2+6C
| 充电 |
| 放电 |

考点:物质分离和提纯的方法和基本操作综合应用,化学电源新型电池
专题:实验设计题,电化学专题
分析:(1)从金属锂的化学性质分析,锂为活泼金属;
(2)碱浸时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;
洗涤沉淀,就是向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复多次;
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
(5)①LiCl溶液加热蒸干,LiCl水解生成的LiOH,受热分解产生Li2O,电解Li2O的熔融物得到氧气;
②当电池消耗72g碳时,发生的是充电反应,B极失电子发生氧化反应.
(2)碱浸时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;
洗涤沉淀,就是向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复多次;
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤;
(5)①LiCl溶液加热蒸干,LiCl水解生成的LiOH,受热分解产生Li2O,电解Li2O的熔融物得到氧气;
②当电池消耗72g碳时,发生的是充电反应,B极失电子发生氧化反应.
解答:
解:(1)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(2)铝能和碱反应生成偏铝酸盐,生成偏铝酸盐,发生的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;
洗涤沉淀,就是向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复2-3次,以便与蒸馏水充分得把可溶性的微粒带走;
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复2-3次;
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,Li2CO3溶解的少,可减少Li2CO3的损失;
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)①LiCl溶液加热蒸干,LiCl水解生成LiOH,受热分解产生Li2O,实际上电解的是LiCl和Li2O的熔融混合物;
故答案为:LiCl水解生成的LiOH受热分解产生Li2O,实际上电解的是LiCl和Li2O的熔融混合物;
②当电池消耗72g碳时,发生的是充电反应,A电极上得电子发生还原反应,则A电极上电极反应式为6C+xLi++xe-=LixC6 ,A极得xmol电子,由于两极通过的电量相等,B极发生氧化反应会失去xmol电子,故答案为:x.
(2)铝能和碱反应生成偏铝酸盐,生成偏铝酸盐,发生的离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;
洗涤沉淀,就是向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复2-3次,以便与蒸馏水充分得把可溶性的微粒带走;
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;向漏斗中加入蒸馏水浸没沉淀,让水自然流下,重复2-3次;
(4)Li2CO3在水中的溶解度随着温度的升高而减小,应趁热过滤,Li2CO3溶解的少,可减少Li2CO3的损失;
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)①LiCl溶液加热蒸干,LiCl水解生成LiOH,受热分解产生Li2O,实际上电解的是LiCl和Li2O的熔融混合物;
故答案为:LiCl水解生成的LiOH受热分解产生Li2O,实际上电解的是LiCl和Li2O的熔融混合物;
②当电池消耗72g碳时,发生的是充电反应,A电极上得电子发生还原反应,则A电极上电极反应式为6C+xLi++xe-=LixC6 ,A极得xmol电子,由于两极通过的电量相等,B极发生氧化反应会失去xmol电子,故答案为:x.
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度中.

练习册系列答案
相关题目
下列分子中所有原子都共平面的是( )
| A、乙烷 | B、丙烯 | C、溴苯 | D、乙醇 |
下列对物质及其变化的有关叙述正确的是( )
| A、干冰气化时碳氧键发生断裂 |
| B、CaO和SiO2晶体中都不存在单个小分子 |
| C、K2O和K2O2中化学键类型完全相同 |
| D、苯分子中只有极性键 |
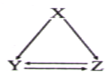 下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | AlCl3 | Al(OH)3 | NaAlO2 |
| B | C | CO | CO2 |
| C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
| D | S | SO2 | SO3 |
| A、A | B、B | C、C | D、D |
在KHSO4的稀溶液和熔融状态下都存在的离子是( )
| A、H+ |
| B、HSO4- |
| C、SO42- |
| D、K+ |
 某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:
某无色溶液中含有NH4+、K+、Al3+、SO42-四种离子,进行如下实验:(1)取10mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀;
(2)取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解.并且随NaOH溶液的加入,沉淀和气体的变化关系如图所示.下列说法不符合事实的是( )
| A、根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B、根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C、另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42-同时完全沉淀 |
| D、NH4+、K+、Al3+、SO42-四种离子的物质的量之比为:2:1:1:3 |

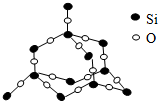 二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题:
二氧化硅晶体是立体的网状结构.其晶体模型如图所示.认真观察晶体模型并回答下列问题: