题目内容
 短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.
短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.(1)写出Z的原子结构示意图
(2)元素Y在周期表中的位置
(3)A与X可形成电子总数为10的微粒,其中形成的分子的结构式为
(4)比较化合物BY2与ZY2的熔点高低:
(5)已知1mol XY2和1mol BY反应生成BY2和XY过程中能量变化如图所示(图中涉及物质均为气态).
请写出XY2和BY反应的热化学方程式
考点:位置结构性质的相互关系应用,反应热和焓变
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,则A是H元素,B的气态氢化物是天然气的主要成分,则B是C元素,Y的最外层电子数是其内层电子数的3倍,最外层电子数小于8,所以Y是O元素,X的原子序数大于B而小于Y,所以X是N元素,Z单质可制成半导体材料,B、Z同主族,则Z是Si元素,再结合物质结构、性质解答.
解答:
解:短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,则A是H元素,B的气态氢化物是天然气的主要成分,则B是C元素,Y的最外层电子数是其内层电子数的3倍,最外层电子数小于8,所以Y是O元素,X的原子序数大于B而小于Y,所以X是N元素,Z单质可制成半导体材料,B、Z同主族,则Z是Si元素,
(1)Z是Si元素,其原子核外有3个电子层、最外层电子数是4,所以其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)Y是O,O原子核外有2个电子层、最外层电子数是6,所以O元素位于第2周期ⅥA族,
故答案为:第2周期ⅥA族;
(3)A与X可形成电子总数为10的微粒是NH3,N原子和每个H原子之间存在一个共价键,其结构式为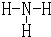 ,形成的铵根离子化学式为NH4+,
,形成的铵根离子化学式为NH4+,
故答案为: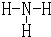 ;NH4+;
;NH4+;
(4)CO2的熔点低于SiO2,二氧化硅属于原子晶体、二氧化碳固体属于分子晶体,分子晶体熔化时破坏分子间作用力,原子晶体熔化时需要破坏共价键,
故答案为:SiO2;CO2;原子;共价键;
(5)根据图象知,△H=134kJ/mol-368kJ/mol=-234 KJ?mol-1,所以其热化学反应方程式为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 KJ?mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 KJ?mol-1.
(1)Z是Si元素,其原子核外有3个电子层、最外层电子数是4,所以其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)Y是O,O原子核外有2个电子层、最外层电子数是6,所以O元素位于第2周期ⅥA族,
故答案为:第2周期ⅥA族;
(3)A与X可形成电子总数为10的微粒是NH3,N原子和每个H原子之间存在一个共价键,其结构式为
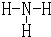 ,形成的铵根离子化学式为NH4+,
,形成的铵根离子化学式为NH4+,故答案为:
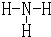 ;NH4+;
;NH4+;(4)CO2的熔点低于SiO2,二氧化硅属于原子晶体、二氧化碳固体属于分子晶体,分子晶体熔化时破坏分子间作用力,原子晶体熔化时需要破坏共价键,
故答案为:SiO2;CO2;原子;共价键;
(5)根据图象知,△H=134kJ/mol-368kJ/mol=-234 KJ?mol-1,所以其热化学反应方程式为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 KJ?mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234 KJ?mol-1.
点评:本题考查了位置结构性质的相互关系及应用,熟悉原子结构及元素周期表结构是解本题关键,根据原子结构特点、物质的组成、物质的用途等知识点确定元素,再结合物质结构性质解答,题目难度不大.

练习册系列答案
相关题目
下列离子在溶液中可以大量共存的一组是( )
| A、H+、Na+、OH-、NO3- |
| B、Na+、Fe3+、NO3-、Cl- |
| C、H+、Fe3+、HCO3-、SO42- |
| D、Ag+、Ca2+、SO42-、CO32- |
醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述不正确的是( )
| A、升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
 某有机物的结构如图所示,这种有机物不可能具有的性质是( )
某有机物的结构如图所示,这种有机物不可能具有的性质是( ) 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: