题目内容
A元素原子M电子层上有6个电子.B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子.
(1)A元素在周期表中的位置 周期, 族.
(2)B元素的原子结构示意图为
(3)AB两元素形成的化合物的名称是 ,化学式是 ,该化合物在无色火焰上着烧时,火焰呈 色.
(1)A元素在周期表中的位置
(2)B元素的原子结构示意图为
(3)AB两元素形成的化合物的名称是
考点:原子结构与元素周期律的关系
专题:
分析:A元素原子M电子层上有6个电子,则A为S元素;B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子,B为Na元素,
(1)主族元素周期数=电子层、主族族序数=最外层电子数;
(2)Na原子核外有11个电子,有3个电子层,各层电子数为2、8、1;
(3)Na与S元素形成的化合物为硫化钠,焰色反应呈黄色.
(1)主族元素周期数=电子层、主族族序数=最外层电子数;
(2)Na原子核外有11个电子,有3个电子层,各层电子数为2、8、1;
(3)Na与S元素形成的化合物为硫化钠,焰色反应呈黄色.
解答:
解:A元素原子M电子层上有6个电子,则A为S元素;B元素与A元素的原子核外电子层数相同,B元素的原子最外电子层只有1个电子,B为Na元素,
(1)S元素原子,核外有3个电子层、最外层电子数为6,处于第三周期ⅥA族,故答案为:三;ⅥA;
(2)Na原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为: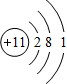 ,故答案为:
,故答案为: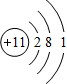 ;
;
(3)Na与S元素形成的化合物为硫化钠,化学式为Na2S,焰色反应呈黄色,故答案为:硫化钠;Na2S;黄.
(1)S元素原子,核外有3个电子层、最外层电子数为6,处于第三周期ⅥA族,故答案为:三;ⅥA;
(2)Na原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为:
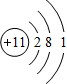 ,故答案为:
,故答案为: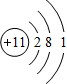 ;
;(3)Na与S元素形成的化合物为硫化钠,化学式为Na2S,焰色反应呈黄色,故答案为:硫化钠;Na2S;黄.
点评:本题考查原子结构与位置关系,比较基础,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各条件下发生反应X+Y=XY时,速率最快的是( )
| A、常温下,20mL中含X、Y各0.003mol的溶液 |
| B、常温下,100mL中含X、Y各0.005mol的溶液 |
| C、常温下,0.1mol/L的X、Y溶液各l0mL相混合 |
| D、标准状况下,0.1mol/L的X、Y溶液各l0mL相混合 |
在容积不变的密闭容器中通入一定量的HI气体,使其在一定条件下发生如下反应:2HI(g)?H2(g)+I2(g).下列叙述中说明该反应到达限度的是( )
| A、混合气体的密度不变时 |
| B、混合气体的颜色不变化时 |
| C、混合气体的总压强不变时 |
| D、υ(HI):υ(H2):υ(I2)=2:1:1时 |
 (1)按如图1装置进行实验,可观察到的现象有:
(1)按如图1装置进行实验,可观察到的现象有: 短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.
短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.