题目内容
7.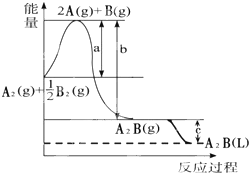 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:(1)a、b、c分别代表什么意义?
a.旧键断裂吸收的能量;b.生成新键放出的能量;c.由气态到液态放出的能量.
(2)该反应是放热还是吸热?放热,△H大于零还是小于零?小于零.
(3)写出A2B(L)分解的热化学反应方程式A2B(L)=A2(g)+$\frac{1}{2}$B2(g)△H=+(b-a+c)kJ/mol.
分析 (1)化学反应的实质为旧键的断裂和新键的形成,断裂化学键吸收能量,生成化学键放出能量,二者的差值是反应的反应热,不同聚集状态的物质,能量不同;
(2)反应物与生成物的总能量不同,结合能量守恒判断反应是吸热反应还是放热反应;
(3)由图象可知A2B吸收能量,结合能量守恒计算.
解答 解:(1)图象中可以分析判断,a代表旧键断裂吸收的能量;c为固体和液体之间的能量差,代表A2B由气态到液态放出的能量,
故答案为:旧键断裂吸收的能量;生成新键放出的能量;由气态到液态放出的能量;
(2)反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0;
故答案为:放热;小于零;
(3)由图象可知A2(g)+$\frac{1}{2}$B2(g)═A2B(g)△H=(a-b)kJ/mol,A2B(g)=A2B(L)△H=-ckJ/mol,则A2B(L)分解的热化学反应方程式为A2B(L)=A2(g)+$\frac{1}{2}$B2(g)△H=+(b-a+c)kJ/mol,
故答案为:A2B(L)=A2(g)+$\frac{1}{2}$B2(g)△H=+(b-a+c)kJ/mol.
点评 本题考查了化学反应的能量变化,图象分析判断,为高频考点,侧重于学生的分析能力的考查,注意把握图象的分析和识别,把握反应热△H=反应物能量总和-生成物能量总和,题目较简单.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
17.信息时代产生的大量电子垃圾对环境构成严重威胁.某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):
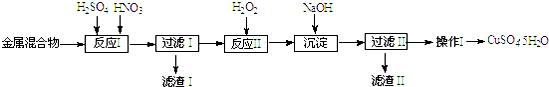
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)滤渣Ⅰ的主要成份是(写化学式)Au、Pt.
(2)反应Ⅱ中加入H2O2的作用是使Fe2+氧化为Fe3+.
(3)生成沉淀反应的离子方程式有Fe3++3OHˉ=Fe(OH)3↓.
(4)操作Ⅰ的步骤是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2++4Iˉ=2CuI↓+I2
C. 继续向上述混合物中,逐滴加入0.1000mol•L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O32-=2Iˉ+S4O62-,则样品中胆矾晶体的质量分数96%.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是使Fe2+氧化为Fe3+.
(3)生成沉淀反应的离子方程式有Fe3++3OHˉ=Fe(OH)3↓.
(4)操作Ⅰ的步骤是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2++4Iˉ=2CuI↓+I2
C. 继续向上述混合物中,逐滴加入0.1000mol•L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O32-=2Iˉ+S4O62-,则样品中胆矾晶体的质量分数96%.
18.乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、
乙酰苯胺的制备原理为

实验参数
实验装置如图所示(部分仪器及夹持装置已略去).
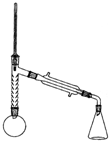
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.②苯胺易被氧化.
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品.
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼.将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化;.
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)通过温度计温度下降或锥形瓶内液体不再增加可判断反应基本完成、
(4)步骤1加热可用油浴(填“水浴”或“油浴”).
(5)洗涤乙酰苯胺粗品最合适的方法是A(填字母).
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是65.7%(小数点后保留两位数字.)
乙酰苯胺的制备原理为

实验参数
| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |

注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离.②苯胺易被氧化.
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105℃左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品.
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼.将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是防止苯胺在反应过程中被氧化;.
(2)从化学平衡的角度分析,控制温度计的温度在105℃左右的原因是不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)通过温度计温度下降或锥形瓶内液体不再增加可判断反应基本完成、
(4)步骤1加热可用油浴(填“水浴”或“油浴”).
(5)洗涤乙酰苯胺粗品最合适的方法是A(填字母).
A.用少量冷水洗B.用少量热水洗
C.先用冷水洗,再用热水洗D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是65.7%(小数点后保留两位数字.)
15.元素周期表中非金属性强的元素主要位于( )
| A. | 左、下方区域 | B. | 左、上方区域 | C. | 右、上方区域 | D. | 右、下方区域 |
2.五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g)?PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示: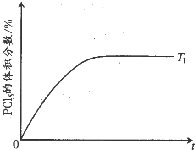
(1)0~150s内的平均反应速率v(PCl3)=1.2×10-3或0.0012mol.L-1•s-1
(2)该温度下,此反应的化学平衡常数的数值为$\frac{5}{6}$(可用分数表示).
(3)反应至250s 时,该反应放出的热量为37.2kJ.
(4)下列关于上述反应的说法中,正确的是abd(填字母序号).
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T 1时,混合气体中PCl5的体积分数随时间t 变化的示意图如下.其他条件相同,请在下图中画出温度为T 2(T 2>T 1)时,PCl5的体积分数随时间变化的曲线.
PCl3(g)+Cl2(g)?PCl5(g)△H=-93.0kJ•mol-1.某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如表所示:

| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(2)该温度下,此反应的化学平衡常数的数值为$\frac{5}{6}$(可用分数表示).
(3)反应至250s 时,该反应放出的热量为37.2kJ.
(4)下列关于上述反应的说法中,正确的是abd(填字母序号).
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T 1时,混合气体中PCl5的体积分数随时间t 变化的示意图如下.其他条件相同,请在下图中画出温度为T 2(T 2>T 1)时,PCl5的体积分数随时间变化的曲线.
19.次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性.下列有关说法正确的是( )
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
17.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
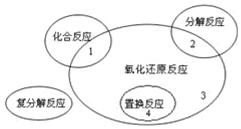

| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
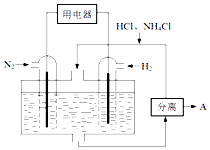 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.