题目内容
13.甲烷与四氯化碳分子的空间构型相同,有关两者的比较中正确的是( )| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
分析 甲烷是正四面体型结构,属于甲烷与四氯化碳分子的空间构型相同,则四氯化碳也是正四面体型结构,键角都是109°28′,两者都是含有极性键的非极性分子,但碳氯键的键长大于碳氢键的键长,键长越短,键能越大,分子越稳定;分子晶体相对分子质量越大,熔沸点越大.
解答 解:A.甲烷与四氯化碳分子都是正四面体型结构,是含有极性键的非极性分子,故A错误;
B.甲烷与四氯化碳分子都是正四面体型结构,键角都是109°28′,故B错误;
C.键长越短,键能越大,分子越稳定,碳氢键的键长小于碳氯键的键长,所以甲烷分子比四氯化碳稳定,故C正确;
D.分子晶体相对分子质量越大,熔沸点越大,所以甲烷沸点低于四氯化碳,故D错误.
故选C.
点评 本题考查了物质的结构与性质,注意物质性质与结构的关系,题目难度不大,注意知识的运用.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
3.常温下,有下列四种溶液:
下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 | |
| C. | ①与③等体积混合后溶液PH为a,②与④等体积混合后溶液PH为b.则a>b | |
| D. | 1ml③和100ml④分别与足量金属镁反应,产生的H2一样多 |
1.室温下,甲乙两烧杯中分别盛有pH=a和pH=(a+1)的醋酸溶液,下列说法正确的是( )
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
8.在0.1mol/L的CH3COOH溶液中存在如下电离平衡CH3COOH?CH3COO-+H+对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
18.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
5.电离平衡常数是衡量弱电解质电离程度的量.已知如表数据(25℃):
(1)25℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c(C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是BD.
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN)=C(OH-) D.C(HCN)+C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-═Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c(C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为0.2mol.
3.下列有关化学用语表示正确的是( )
| A. | 二氧化碳的分子式: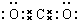 | |
| B. | Cl-的结构示意图: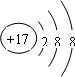 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 质子数为53、中子数为78 的碘原子:${\;}_{53}^{131}$I |