题目内容
8.在0.1mol/L的CH3COOH溶液中存在如下电离平衡CH3COOH?CH3COO-+H+对于该平衡,下列叙述正确的是( )| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
分析 A、醋酸溶液中组存在电离平衡,加入碱促进电离;
B、加水稀释促进电离,各离子浓度减小;
C、0.1mol/L的CH3COOH溶液中氢离子浓度小于0.1mol/L,0.1mol/LHCl溶液中氢离子浓度等于0.1mol/L;
D、醋酸钠溶解后醋酸根离子抑制醋酸的电离.
解答 解:A、醋酸溶液中组存在电离平衡,加入氢氧化钠固体溶解后,碱和氢离子反应促进电离;平衡正向进行,故A正确;
B、加入水时,稀释溶液促进电离,离子浓度减小,反应速率减小,平衡向正反应方向移动,故B错误;
C、0.1mol/L的CH3COOH溶液中氢离子浓度小于0.1mol/L,滴加少量0.1mol/LHCl溶液,其中氢离子浓度等于0.1mol/L,溶液中c(H+)增加,故C错误;
D、加入少量CH3COONa固体,溶解后醋酸根离子抑制醋酸电离,平衡向逆反应方向移动,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡的影响因素分析和平衡移动方向的判断,电离是吸热过程,酸碱盐的影响分析是解题关键.

练习册系列答案
相关题目
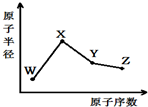
18.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
( )
( )

| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
16.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.3mol Na2O2与盐酸反应,转移的电子数为0.6NA | |
| B. | 2L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.4NA | |
| C. | 标准状况下,4.48L O2所含有的共用电子对数目为0.2NA | |
| D. | 在常温下,0.3mol NaHSO4固体中含有的离子数目为0.6NA |
13.甲烷与四氯化碳分子的空间构型相同,有关两者的比较中正确的是( )
| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
20.下列说法法正确的是( )
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 用湿润的蓝色石蕊试纸检验氨气 | |
| C. | 硅酸钠溶液应保存在带玻璃塞的试剂瓶中 | |
| D. | 锌与稀硫酸反应时,要加快反应速率可滴加少量硫酸铜 |
17.在理论上不能用于设计原电池的化学反应是( )
| A. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) | D. | 2H2(g)+O2(g)═2H2O(l) |
18.下列有关碳酸(H2CO3)和硅酸(H2SiO3)的说法中不正确的是( )
| A. | 两者均为弱酸 | |
| B. | 两者均可使紫色石蕊试液变红色 | |
| C. | CO2气体通入Na2SiO3溶液中可以制得硅酸 | |
| D. | 两者受热时均可以分解 |