题目内容
3.在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1,达到平衡时浓度可能正确的是( )| A. | SO2为0.3 mol•L-1 | |
| B. | SO2、O2分别为0.4 mol•L-1、0.2 mol•L-1 | |
| C. | SO2、SO3均为0.25 mol•L-1 | |
| D. | SO2、SO3分别为0.24 mol•L-1、0.14 mol•L-1 |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,假设反应正向进行到底,可求反应物浓度的最小值和生成物浓度的最大值;假设反应逆向进行到底,可求反应物浓度的最大值和生成物浓度的最小值;可逆反应不能进行到底,则各物质的浓度范围:0<c(SO2)<0.4 mol•L-1,0<c(SO3)<0.4 mol•L-1,0<c(O2)<0.2 mol•L-1,结合选项及原子守恒分析.
解答 解:A、SO2浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,而实际变化小于该值,故A正确;
B、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,而实际变化等于该值,故B错误;
C、反应物、生产物的浓度不可能同时增大,应一个减小,另一个一定增大,故C错误;
D、SO3的浓度减少,说明该反应向逆反应方向进行建立平衡,SO3浓度变为0.14mol•L-1,则参与反应的SO3浓度变为0.06mol•L-1,则SO2的浓度的浓度变化为0.06mol/L,浓度变为0.26mol•L-1,故D错误.
故选A.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 L 1 mol•L-1 K2SO4溶液中含有的钾离子数为2NA | |
| B. | 1mol氯气完全反应生成氯离子得到的电子数为NA | |
| C. | 22 g CO2中含有的分子数为NA | |
| D. | 常温常压下,22.4 L N2中含有的分子数为NA |
19.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| B. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 足量铜与18mol•L-11L浓硫酸反应可以得到SO2的分子总数为9NA |
8. 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )| A. | 该有机物的核磁共振氢谱图中有6个吸收峰 | |
| B. | 该有机物的分子式为C12H18N2Cl2O | |
| C. | 该有机物能溶于水,且水溶液显碱性 | |
| D. | 该有机物能发生加成反应、取代反应、氧化反应和酯化反应 |
13.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 二氧化硫可以用来漂白食品 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 镁可用于制造信号弹和焰火 |

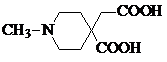 .
.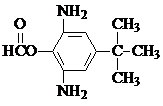 或
或 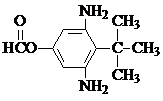 .
. 和CH3CH2Cl为原料制备
和CH3CH2Cl为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: