题目内容
8. 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )| A. | 该有机物的核磁共振氢谱图中有6个吸收峰 | |
| B. | 该有机物的分子式为C12H18N2Cl2O | |
| C. | 该有机物能溶于水,且水溶液显碱性 | |
| D. | 该有机物能发生加成反应、取代反应、氧化反应和酯化反应 |
分析 根据有机物结构简式可确定有机物的分子式,该有机物含有氨基,具有碱性,可与酸反应,含有羟基,可发生取代、氧化反应,含有Cl原子,可发生取代反应,以此解答该题.
解答 解:A.由结构简式可知含有7种位置的H,则核磁共振氢谱图中有7个吸收峰,故A错误;
B.由结构简式可知有机物的分子式为C12H18N2Cl2O,故B正确;
C.含有氨基,为碱性基团,故C正确;
D.含苯环能与氢气发生加成反应,含-OH可发生氧化和酯化反应,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高考常见题型,注意把握有机物的结构和官能团的性质,为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
6.将26.8克KCl和KBr的混合物,溶于水配成500ml溶液,通入过量的Cl2,反应后将溶液蒸干,得固体22.35克.则原来所配溶液中K+、Cl-、Br-的物质的量之比为( )
| A. | 3:1:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:3:2 |
4.下列说法正确的是( )
| A. | 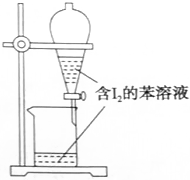 萃萃取碘水中的I2,分出水层的操作 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 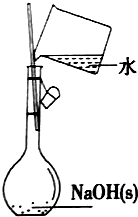 配制0.1mol•L-1的NaOH溶液 |
3.在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1,达到平衡时浓度可能正确的是( )
| A. | SO2为0.3 mol•L-1 | |
| B. | SO2、O2分别为0.4 mol•L-1、0.2 mol•L-1 | |
| C. | SO2、SO3均为0.25 mol•L-1 | |
| D. | SO2、SO3分别为0.24 mol•L-1、0.14 mol•L-1 |
13.下表列出了A~F,6种元素在周期表中的位置:
(1)这六种元素分别是:A.Na,B.Mg,C.Al,D.C,E.S,F.F(填元素符号).
(2)A、B、C三种元素的氧化物对应的水化物,其中碱性最强的是(填化学式)NaOH.
(3)D、E、F三种元素中非金属性最强的是F(填元素符号).
| 主族 周期 | IA | ⅡA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | F | |||||
| 3 | A | B | C | E |
(2)A、B、C三种元素的氧化物对应的水化物,其中碱性最强的是(填化学式)NaOH.
(3)D、E、F三种元素中非金属性最强的是F(填元素符号).
18.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.X的平均反应速率是( )
| A. | 0.03 mol•L-1•s-1 | B. | 0.03 mol•L-1•min-1 | ||
| C. | 0.01 mol•L-1•s-1 | D. | 0.01 mol•L-1•min-1 |


 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O
+2H2O 
 B.
B.
