题目内容
下列说法正确的是( )
| A、pH=3的HX与pH=11的YOH等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、向醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.4 mol/LHCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A、pH=3的HX酸与pH=11的YOH碱等体积混合,由于酸和碱是强还是弱,未说明,也就不能判断生成的盐水能否水解,所以所得溶液的pH不一定为7,据此判断;
B、根据电解质溶液中电荷守恒判断;
C、根据电荷守恒判断;
D、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,AlO2-全部转化为Al3+,溶液中的溶质是NaCl和AlCl3,根据元素守恒判断.
B、根据电解质溶液中电荷守恒判断;
C、根据电荷守恒判断;
D、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,AlO2-全部转化为Al3+,溶液中的溶质是NaCl和AlCl3,根据元素守恒判断.
解答:
解:A、pH=3的HX酸与pH=11的YOH碱等体积混合,由于酸和碱是强还是弱,未说明,也就不能判断生成的盐水能否水解,所以所得溶液的pH不一定为7,故A错误;
B、根据电解质溶液中电荷守恒可知,c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+2c(SO42-),故B错误;
C、向醋酸钠溶液中加入适量醋酸,溶液中存在四种离子:H+、OH-、Na+、CH3COO-,由于所得溶液为酸性,即c(H+)>c(OH-),根据电荷守恒可知,则有c(Na+)<c(CH3COO-),则溶液中的离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,AlO2-全部转化为Al3+,溶液中的溶质是等物质的量浓度的NaCl和AlCl3,而Al3+是弱碱阳离子,能水解,溶液呈酸性,再根据元素守恒可知,c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确;
故选D.
B、根据电解质溶液中电荷守恒可知,c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+2c(SO42-),故B错误;
C、向醋酸钠溶液中加入适量醋酸,溶液中存在四种离子:H+、OH-、Na+、CH3COO-,由于所得溶液为酸性,即c(H+)>c(OH-),根据电荷守恒可知,则有c(Na+)<c(CH3COO-),则溶液中的离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D、0.4 mol/L HCl与0.1 mol/L NaAlO2等体积混合,AlO2-全部转化为Al3+,溶液中的溶质是等物质的量浓度的NaCl和AlCl3,而Al3+是弱碱阳离子,能水解,溶液呈酸性,再根据元素守恒可知,c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确;
故选D.
点评:本题主要考查了强弱电解质、盐类水解、离子浓度大小比较等知识点,难度不大,解题时注意D选项中的反应物的量与产物之间的关系

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在常温下,某溶液中由水电离出的 c(H+)=1×10-11mol?L-1,下列说法正确的是( )
| A、该溶液肯定显碱性 |
| B、该溶液肯定显酸性 |
| C、该溶液的pH可能是11,也可能是3 |
| D、该溶液的pH肯定不是11 |
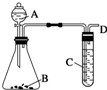 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.
 维生素C的结构简式如图,它的分子式是
维生素C的结构简式如图,它的分子式是