题目内容
在20℃时,在100g水中溶解11.1g K2SO4恰好达到饱和,此饱和溶液的密度为1.08g/cm3.将350mL此温度下的K2SO4饱和溶液用水稀释至500mL.计算稀释后溶液中K2SO4的质量分数和溶液中K2SO4的物质的量浓度(要有计算过程).
考点:溶液中溶质的质量分数及相关计算
专题:物质的量浓度和溶解度专题
分析:根据公式c=
计算稀释前溶质的物质的量浓度,根据稀释前后硫酸钾溶液的溶质物质的量不变,计算稀释后的浓度,根据质量分数是溶质质量和溶液质量的比值来计算即可.
| 1000ρw% |
| M |
解答:
解:稀释前溶质的物质的量浓度c=
=
mol/L=0.62mol/L,稀释前后硫酸钾溶液的溶质物质的量不变,设:稀释后的浓度是x,则0.62mol/L×0.35L=0.5x,解得x≈0.43mol/L,稀释后溶液中K2SO4的质量分数=
×100%≈4.25%.
答:稀释后溶液中K2SO4的质量分数是4.25%,溶液中K2SO4的物质的量浓度是0.43mol/L.
| 1000ρw% |
| M |
1000×1.08×
| ||
| 174 |
| 11.1 |
| 100+11.1+150 |
答:稀释后溶液中K2SO4的质量分数是4.25%,溶液中K2SO4的物质的量浓度是0.43mol/L.
点评:本题考查物质的量浓度、质量分数的计算,关键是对计算公式理解,难度不大,注意公式的应用是关键.

练习册系列答案
相关题目
下列有关实验室一般事故的预防和处理方法正确的是( )
| A、如果苯酚浓溶液沾到皮肤上,应立即用稀氢氧化钠溶液清洗 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭 |
| D、蒸发溶液时有液滴飞溅,应立即加水冷却 |
下列热化学方程式能表示可燃物燃烧热的是( )
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3 kJ?mol-1 | ||
| C、2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1 | ||
D、CO(g)+
|
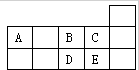 如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )
如表为元素周期表短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是( )| A、A与B形成的阴离子可能有:AB32-、A2B42- |
| B、E的氢化物的沸点比C的氢化物的沸点低 |
| C、D在过量的B中燃烧的主要产物为DB3 |
| D、这5种元素形成只含极性键的非极性分子多于4种 |
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-Q1 kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q3 kJ/mol
取体积比4:1的混合气112L(标况),完全燃烧后恢复到常温,放出热量为( )
2H2(g)+O2(g)=2H2O(g);△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q3 kJ/mol
取体积比4:1的混合气112L(标况),完全燃烧后恢复到常温,放出热量为( )
| A、4Q1+0.5Q3 |
| B、4Q1+0.5Q2 |
| C、4Q1+Q3 |
| D、4Q1+2Q2 |
下列物质中既属于无机物,又属于碱的是( )
| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、CH3CH2OH |
| D、Mg(OH)2 |
下列说法正确的是( )
| A、pH=3的HX与pH=11的YOH等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、向醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.4 mol/LHCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
