题目内容
废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下.
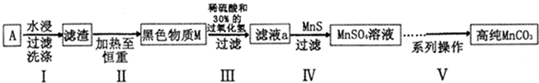
(1)碱性锌锰干电池的负极材料是 (填化学式).
(2)第Ⅰ步操作得滤渣的成分是 ;第Ⅱ步操作的目的是 .
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为 .
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为 .
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7.
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7
操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液
操作4:用少量无水乙醇洗涤2~3次
操作5:低温烘干.
①试剂X是 ;
②操作3中,说明SO42-已除干净的方法是 .

(1)碱性锌锰干电池的负极材料是
(2)第Ⅰ步操作得滤渣的成分是
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn(OH)2开始沉淀时pH为7.7.
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7
操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液
操作4:用少量无水乙醇洗涤2~3次
操作5:低温烘干.
①试剂X是
②操作3中,说明SO42-已除干净的方法是
考点:制备实验方案的设计
专题:实验设计题
分析:废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,加水溶解、过滤、洗涤,滤液中含有NH4Cl、ZnCl2、FeCl2,滤渣为
MnO2和碳粉,加热至恒重,碳转化为二氧化碳气体,再向黑色固体M中加稀硫酸和30%的过氧化氢溶液,过滤,滤液a为硫酸锰溶液,再加MnS除去溶液中少量的锌离子,过滤得到硫酸锰溶液,然后得到碳酸锰;
(1)碱性锌锰干电池中失电子的为负极;
(2)MnO2和碳粉均不能溶于水,除去碳粉可以加热;
(3)MnO2与稀H2SO4、H2O2反应生成硫酸锰;
(4)根据沉淀的转化分析;
(5)MnSO4溶液操作1为加入碳酸钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;低温烘干得到纯净的MnCO3;
操作1:加入Na2CO3把MnSO4转化为MnCO3;
操作3:利用SO42-和Ba2+反应生成硫酸钡白色沉淀,来检验滤液中是否含有SO42-.
MnO2和碳粉,加热至恒重,碳转化为二氧化碳气体,再向黑色固体M中加稀硫酸和30%的过氧化氢溶液,过滤,滤液a为硫酸锰溶液,再加MnS除去溶液中少量的锌离子,过滤得到硫酸锰溶液,然后得到碳酸锰;
(1)碱性锌锰干电池中失电子的为负极;
(2)MnO2和碳粉均不能溶于水,除去碳粉可以加热;
(3)MnO2与稀H2SO4、H2O2反应生成硫酸锰;
(4)根据沉淀的转化分析;
(5)MnSO4溶液操作1为加入碳酸钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;低温烘干得到纯净的MnCO3;
操作1:加入Na2CO3把MnSO4转化为MnCO3;
操作3:利用SO42-和Ba2+反应生成硫酸钡白色沉淀,来检验滤液中是否含有SO42-.
解答:
解:废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,加水溶解、过滤、洗涤,滤液中含有NH4Cl、ZnCl2、FeCl2,滤渣为MnO2和碳粉,加热至恒重,碳转化为二氧化碳气体,再向黑色固体M中加稀硫酸和30%的过氧化氢溶液,过滤,滤液a为硫酸锰溶液,再加MnS除去溶液中少量的锌离子,过滤得到硫酸锰溶液,然后得到碳酸锰;
(1)碱性锌锰干电池中失电子的为负极,则锌为负极,故答案为:Zn;
(2)MnO2和碳粉均不能溶于水,过滤得到的滤渣为MnO2和碳粉,除去碳粉可以加热,所以第Ⅱ步操作加热的目的是除去碳粉;
故答案为:MnO2和碳粉;除去碳粉;
(3)MnO2与稀H2SO4、H2O2反应生成硫酸锰,其反应的方程式为:MnO2+H2SO4+H2O2=MnSO4+O2↑+2H2O;
故答案为:MnO2+H2SO4+H2O2=MnSO4+O2↑+2H2O;
(4)已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24,MnS可以转化为ZnS,所以除去Zn2+可以用MnS,其离子方程式为:Zn2++MnS=ZnS+Mn2+;
故答案为:Zn2++MnS=ZnS+Mn2+;
(5)MnSO4溶液中加入碳酸钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤沉淀2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;最后低温烘干得到纯净的MnCO3;
操作1:若要把MnSO4转化为MnCO3,要加入Na2CO3;故答案为:Na2CO3;
操作3:利用SO42-和Ba2+反应生成硫酸钡白色沉淀,来检验滤液中是否含有SO42-,则操作为:取少量的最后一次洗液于试管中,再加入氯化钡溶液,观察是否浑浊,若无白色沉淀生成,说明SO42-已经除尽;
故答案为:取少量的最后一次洗液于试管中,再加入氯化钡溶液,观察是否浑浊,若无白色沉淀生成,说明SO42-已经除尽.
(1)碱性锌锰干电池中失电子的为负极,则锌为负极,故答案为:Zn;
(2)MnO2和碳粉均不能溶于水,过滤得到的滤渣为MnO2和碳粉,除去碳粉可以加热,所以第Ⅱ步操作加热的目的是除去碳粉;
故答案为:MnO2和碳粉;除去碳粉;
(3)MnO2与稀H2SO4、H2O2反应生成硫酸锰,其反应的方程式为:MnO2+H2SO4+H2O2=MnSO4+O2↑+2H2O;
故答案为:MnO2+H2SO4+H2O2=MnSO4+O2↑+2H2O;
(4)已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24,MnS可以转化为ZnS,所以除去Zn2+可以用MnS,其离子方程式为:Zn2++MnS=ZnS+Mn2+;
故答案为:Zn2++MnS=ZnS+Mn2+;
(5)MnSO4溶液中加入碳酸钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤沉淀2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;最后低温烘干得到纯净的MnCO3;
操作1:若要把MnSO4转化为MnCO3,要加入Na2CO3;故答案为:Na2CO3;
操作3:利用SO42-和Ba2+反应生成硫酸钡白色沉淀,来检验滤液中是否含有SO42-,则操作为:取少量的最后一次洗液于试管中,再加入氯化钡溶液,观察是否浑浊,若无白色沉淀生成,说明SO42-已经除尽;
故答案为:取少量的最后一次洗液于试管中,再加入氯化钡溶液,观察是否浑浊,若无白色沉淀生成,说明SO42-已经除尽.
点评:本题考查了物质的分离提纯实验操作,涉及原电池原理、物质的分离、沉淀的转化、氧化还原反应、洗涤操作等,题目难度中等,侧重于考查学生的实验能力和对基础知识的应用能力.

练习册系列答案
相关题目
下列热化学方程式能表示可燃物燃烧热的是( )
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3 kJ?mol-1 | ||
| C、2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ?mol-1 | ||
D、CO(g)+
|
下列物质中既属于无机物,又属于碱的是( )
| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、CH3CH2OH |
| D、Mg(OH)2 |
下列说法正确的是( )
| A、pH=3的HX与pH=11的YOH等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、向醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.4 mol/LHCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
测定空气中污染物含量的一种方法是:将一定体积的空气通入吸收剂,并测定其导电能力的变化.用上述方法测定空气中氯气的含量时,导电能力变化最大的是( )
| A、H2S溶液 |
| B、KI溶液 |
| C、NaOH溶液 |
| D、Na2S溶液 |


