题目内容
2.写出下列电池的电极反应方程式(1)铜-锌原电池,电解质溶液为硫酸铜.正极Cu2++2e-=Cu
(2)镁-铝原电池,电解质溶液为氢氧化钠.正极2H2O+2e-=2OH-+H2↑
(3)铜-铁原电池,电解质溶液为浓硝酸.正极2NO3-+2e-+4H+=2NO2↑+2H2O
(4)氢氧燃料电池,电解质溶液为硫酸.负极H2-2e-=2H+
(5)氢氧燃料电池,电解质溶液为氢氧化钠.负极H2-2e-+2OH-═2H2O.
分析 (1)铜-锌原电池,电解质溶液为硫酸铜,Zn易失电子作负极、Cu作正极,正极上铜离子得电子发生还原反应;
(2)Mg、Al和NaOH溶液构成的原电池中,Al易失电子作负极、Mg作正极,正极上得电子发生还原反应;
(3)Cu、Fe和浓硝酸构成的原电池中,Cu易失电子作负极、Fe作正极,正极上硝酸根离子得电子发生还原反应;
(4)氢氧燃料酸性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子生成氢离子;
(5)氢氧燃料碱性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子和氢氧根离子反应生成水.
解答 解:(1)铜-锌原电池,电解质溶液为硫酸铜,Zn易失电子作负极、Cu作正极,正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(2)Mg、Al和NaOH溶液构成的原电池中,Al易失电子作负极、Mg作正极,正极上得电子发生还原反应,电极反应式为2H2O+2e-=2OH-+H2↑,
故答案为:2H2O+2e-=2OH-+H2↑;
(3)Cu、Fe和浓硝酸构成的原电池中,Cu易失电子作负极、Fe作正极,正极上硝酸根离子得电子发生还原反应,电极反应式为2NO3-+2e-+4H+=2NO2↑+2H2O,
故答案为:2NO3-+2e-+4H+=2NO2↑+2H2O;
(4)氢氧燃料酸性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子生成氢离子,电极反应式为H2-2e-=2H+,
故答案为:H2-2e-=2H+;
(5)氢氧燃料碱性电池中,氢气失电子,则通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-═2H2O,故答案为:H2-2e-+2OH-═2H2O.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性判断正负极,不能根据金属活动性强弱判断正负极,为易错题.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | Ca2+、PO${\;}_{4}^{3-}$ | B. | Ca2+、Cl- | C. | Na+、PO${\;}_{4}^{3-}$ | D. | Mg2+、PO${\;}_{4}^{3-}$ |
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 石油的主要成分是烷烃 | ||
| C. | 甲烷是含碳量最低的碳氢化合物 | D. | 碳氢化合物中的化学键都是极性键 |
| A. | 1 L溶液中K+浓度是0.3 mol/L | B. | 1 L溶液中含0.3NA个K+ | ||
| C. | 2 L溶液中K+浓度是1.2 mol/L | D. | 2 L溶液中含1.2NA个K+ |
| A. | 灼烧 | B. | 滴加硫酸钠溶液 | C. | 滴加食盐水溶液 | D. | 滴加硫酸铜溶液 |
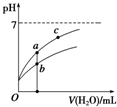 25℃时某些弱酸的电离平衡常数如下表所示:
25℃时某些弱酸的电离平衡常数如下表所示:| CH3COOH | HClO | H2CO3 |
| K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
| A. | 相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO-)>c(CH3COO-)>c(OH-) | |
| B. | 图象中a、c两点所处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| C. | 图象中a点酸的浓度大于b点酸的浓度 | |
| D. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- |
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的氧化物对应的水化物都是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的强 |
| A. | 苯与溴水混合,水层褪色 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲苯制三硝基甲苯 | D. | 苯和氢气在一定条件下生成环已烷 |
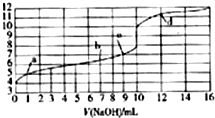
| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |