题目内容
3. 120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )
120℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7g,再通过碱石灰,碱石灰增重4.4g,对该有机物进行核磁共振分析,谱图如图所示:则该有机物可能是( )| A. | CH3CH3 | B. | CH3CH2COOH | C. | CH3CH2OH | D. | CH3CH(OH)CH3 |
分析 浓硫酸质量增重为生成水的质量,碱石灰增重为生成二氧化碳的质量,计算二氧化碳、水的物质的量,确定有机物中C、H原子数目之比,有机物核磁共振氢谱有3个吸收峰,则有机物分子中有3种化学环境不同的H原子,结合选项判断.
解答 解:浓硫酸增重为水的质量,则n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.3mol,
碱石灰增重为二氧化碳的质量,则n(C)=n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,
则有机物中C、H原子数目之比为0.1mol:0.3mol=1:3,由H原子饱和碳的四价结构可知,分子中含有2个C原子、6个H原子,
核磁共振中有3种峰,所以分子中含有3种氢原子,选项中CH3CH2OH符合,
故选:C.
点评 本题考查有机物分子式确定,注意的是核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比.

练习册系列答案
相关题目
13.2005年1月14日,欧洲航天局的“惠更斯”号探测器首次成功登陆土星的最大卫星--土卫六.科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物.下列关于碳氢化合物的叙述正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | B. | 石油的主要成分是烷烃 | ||
| C. | 甲烷是含碳量最低的碳氢化合物 | D. | 碳氢化合物中的化学键都是极性键 |
14.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14.X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族.下列说法错误的是( )
| A. | 原子半径:r(Y)<r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的氧化物对应的水化物都是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的强 |
11.下列变化属于取代反应的是( )
| A. | 苯与溴水混合,水层褪色 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲苯制三硝基甲苯 | D. | 苯和氢气在一定条件下生成环已烷 |
8.某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
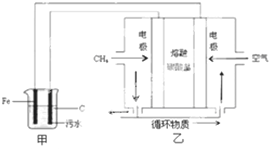

| A. | 通入空气的电极为阳极 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-=Fe3+ | |
| C. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
15.某有机物的结构简式如下: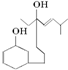 下列说法中正确的是( )
下列说法中正确的是( )
 下列说法中正确的是( )
下列说法中正确的是( )| A. | 该有机物的分子式为C17H29O2 | B. | 分子中有苯环 | ||
| C. | 能够使高锰酸钾溶液褪色 | D. | 只有一个官能团 |
12.向10mL0.10mol•L-1某一元酸HA溶液中滴加等浓度的NaOH溶液,滴加过程溶液的pH随滴加NaOH溶液体积的变化如图所示,下列叙述正确的是( )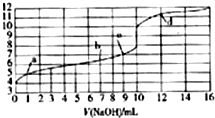

| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |
13.符合下列要求的同分异构体数目(不考虑立体异构)最少的是( )
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C5H12O的醇 | ||
| C. | 分子式为C5H10O2的羧酸 | D. | 分子式为C5H10O2的酯 |
 .
.