题目内容
20.室温下,对于0.10mol•L-1的氨水,下列判断正确的是( )| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 其溶液的pH=13 | |
| C. | 用HNO3溶液完全中和后,溶液显中性 | |
| D. | 加入少量NH4Cl固体后,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值变小 |
分析 A.书写离子方程式时,弱电解质要写化学式;
B.一水合氨是弱电解质,在氨水中部分电离;
C.硝酸铵为强酸弱碱盐,其溶液呈酸性;
D.加入少量NH4Cl固体后发生同离子效应.
解答 解:A.一水合氨是弱电解质,离子方程式中要写化学式,该反应的离子方程式为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.一水合氨是弱电解质,在氨水中部分电离,所以0.10mol•L-1氨水的pH小于13,故B错误;
C.二者恰好反应生成硝酸铵,硝酸铵为强酸弱碱盐,其溶液呈酸性,故C错误;
D.加入少量NH4Cl固体后发生同离子效应,氨水的电离平衡逆向移动,氢氧根离子浓度减小,一水合氨的浓度变大,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值变小,故D正确;
故选D.
点评 本题考查弱电解质电离,侧重考查离子方程式书写、盐溶液酸碱性、pH计算等知识点,学生只要掌握电离平衡的移动就可以迅速解题,题目难度不大.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数的数值,下列对0.3mol/L K2SO4溶液的说法中,正确的是( )
| A. | 1 L溶液中K+浓度是0.3 mol/L | B. | 1 L溶液中含0.3NA个K+ | ||
| C. | 2 L溶液中K+浓度是1.2 mol/L | D. | 2 L溶液中含1.2NA个K+ |
11.下列变化属于取代反应的是( )
| A. | 苯与溴水混合,水层褪色 | B. | 乙烯使溴的四氯化碳溶液褪色 | ||
| C. | 甲苯制三硝基甲苯 | D. | 苯和氢气在一定条件下生成环已烷 |
8.某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
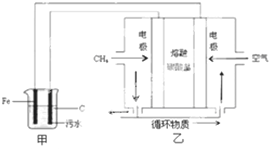

| A. | 通入空气的电极为阳极 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-=Fe3+ | |
| C. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
15.某有机物的结构简式如下: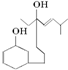 下列说法中正确的是( )
下列说法中正确的是( )
 下列说法中正确的是( )
下列说法中正确的是( )| A. | 该有机物的分子式为C17H29O2 | B. | 分子中有苯环 | ||
| C. | 能够使高锰酸钾溶液褪色 | D. | 只有一个官能团 |
5.下列离子方程式正确的是( )
| A. | 向含有Fe203的悬浊液中通入HI:Fe203+6H+═2Fe3++3H20 | |
| B. | 1 mol/L NaAl02溶液和1.5 mol/L HC1溶液等体积混合:6AlO2-+9H++3H2O═5A1(OH)3+Al3+ | |
| C. | 向Ca( Cl0)2溶液中通入S02:Ca2++2ClO-+S02+H20═CaSO3+2HC1O | |
| D. | 向0.1 mol/LpH=l的NaHA溶液中加入NaOH溶液:HA-+OH-═H2O+A2- |
12.向10mL0.10mol•L-1某一元酸HA溶液中滴加等浓度的NaOH溶液,滴加过程溶液的pH随滴加NaOH溶液体积的变化如图所示,下列叙述正确的是( )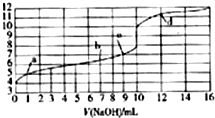

| A. | HA为一元强酸 | |
| B. | 水的电离程度:a点>b点>c点 | |
| C. | c点时,酸和碱恰好完全反应 | |
| D. | d点时,溶液中离子浓度:c(Na+)>c(A-)>c(OH-)>c(H+) |
9. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池中电极b是正极 | |
| B. | 外电路中电子由电极b通过导线流向电极a | |
| C. | 该电池的正极反应为O2+4H++4e-=2H2O | |
| D. | 该电池的总反应:2H2+O2=2H2O |
10.在25℃时,向10mL0.01mol•L-1NaX溶液中逐滴加入0.01mol•L-1的盐酸溶液,滴定过程中溶液中HX、X-浓度所占分数(φ)随pH的变化曲线如图所示,据此判断下列说法中正确的是( )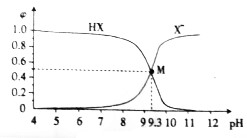

| A. | 25℃时,$\frac{c(HX)}{c({X}^{-})•c({H}^{+})}$=109.3 | |
| B. | M点溶液中存在:c(X-)+c(OH-)=c(H+)+c(Na+) | |
| C. | 滴加盐酸的过程中,水的电离程度先减小后增大 | |
| D. | 常温下,等浓度等体积的HX和NaX溶液混合后,溶液显酸性 |