题目内容
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0 一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的15/16,则N2的转化率a1= ;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
①在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0.该反应的反应速率(v)随时间(t)变化的关系如图1所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) .

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
②积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1 a2
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 .
(4)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图2所示.该反应△H 0(填“>”或“<”).
(1)以N2和H2为原料合成氨气.反应N2(g)+3H2(g)?2NH3(g)△H<0 一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的15/16,则N2的转化率a1=
(2)以氨气、空气为主要原料制硝酸.
①在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0.该反应的反应速率(v)随时间(t)变化的关系如图1所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
②积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2 (g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1,a2.已知T1<T2,则a1
A.大于 B.小于 C.等于 D.以上都有可能
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是
(4)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图2所示.该反应△H
考点:化学平衡的计算,化学平衡状态的判断,转化率随温度、压强的变化曲线
专题:
分析:(1)反应的方程式为N2(g)+3H2(g)?2NH3(g),依据化学平衡三段式列式计算得到;恒压容器中压强大于恒容容器中,平衡正向进行,转化率增大;
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡;
b.该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图,据此判断.
(3)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数并进行相应的运算;
②根据n=
计算NO2的物质的量,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,根据注意电子数计算生成NO3-的物质的量,再根据电子转移守恒计算N元素在还原产物中的化合价,判断还原产物,据此书写;
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡;
b.该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图,据此判断.
(3)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数并进行相应的运算;
②根据n=
| m |
| M |
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答:
解:(1)N2(g)+3H2(g)?2NH3(g)
开始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol)1-x 3-3x 2x
=
,
x=0.125,
N2的转化率a1=
×100%=12.5%,
正反应是气体体积减小的反应,容器压强恒定,相当于在恒容的条件下增大压强,平衡向正反应进行,氮气的转化率增大,所以a2>a1,
故答案为:12.5%;>;
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故a正确;
b.正反应是吸热反应,升高温度平衡向正反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,但该反应正反应是气体体积减小的反应,增大压强平衡也向正反应进行,故t2时为升高温度或增大压强,故b错误;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故c错误;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故d正确;
故选ad;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图为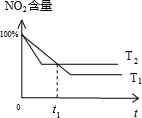 ,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;
,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;
(3)①已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
Ⅱ、N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
由盖斯定律可知,Ⅰ×2-Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),
故△H=2×(-483.5kJ/mol)-133kJ/mol=-1100kJ/mol,
故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol;
②9.2gNO2的物质的量=
,反应中只有NO2中N元素化合价发生变化,发生歧化反应,有生成NO3-,
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为
=0.1mol,故被还原的氮原子物质的量为0.2mol-0.1mol=0.1mol,令N元素在还原产物中的化合价为x价,则0.1mol×(4-x)=0.1mol,解得x=+3,故还原产物为NO2-,且生成的NO3-和NO2-物质的量之比为1:1,同时反应生成CO2,故二氧化氮和碳酸钠溶液反应的离子反应方程式为:2NO2+CO32-=NO3-+NO2-+CO2,故答案为:2NO2+CO32-=NO3-+NO2-+CO2;
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动,正反应为放热反应,△H<0,故答案为:<.
开始(mol) 1 3 0
转化(mol) x 3x 2x
平衡(mol)1-x 3-3x 2x
| 1-x+3-3x+2x |
| 1+3 |
| 15 |
| 16 |
x=0.125,
N2的转化率a1=
| 0.125mol |
| 1mol |
正反应是气体体积减小的反应,容器压强恒定,相当于在恒容的条件下增大压强,平衡向正反应进行,氮气的转化率增大,所以a2>a1,
故答案为:12.5%;>;
(2)①a.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故a正确;
b.正反应是吸热反应,升高温度平衡向正反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,但该反应正反应是气体体积减小的反应,增大压强平衡也向正反应进行,故t2时为升高温度或增大压强,故b错误;
c.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故c错误;
d.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故d正确;
故选ad;
②升高温度平衡向逆反应进行,平衡时二氧化氮的含量增大,温度越高反应速率越快,到达平衡的时间越短,据此作出二氧化氮含量与时间关系草图为
 ,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;
,由图可知,t1时刻a1=a2,t1时刻之前a1>a2,t1时刻之后a1<a2,故答案为:D;(3)①已知:Ⅰ、2H2(g)+O2(g)=2H2O(g)△H=-483.5kJ/mol
Ⅱ、N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
由盖斯定律可知,Ⅰ×2-Ⅱ得4H2(g)+2NO2(g)=N2(g)+4H2O(g),
故△H=2×(-483.5kJ/mol)-133kJ/mol=-1100kJ/mol,
故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100kJ/mol;
②9.2gNO2的物质的量=
| 9.2g |
| 46g/mol |
0.2mol二氧化氮转移电子的物质的量是0.1mol,故生成的NO3-的物质的量为
| 0.1mol |
| 5-4 |
(4)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动,正反应为放热反应,△H<0,故答案为:<.
点评:本题是一道很好的综合试题,适合当前的高考思路,综合性强.同时考查了学生的识图能力.这是学生必备的能力,题目难度中等.

练习册系列答案
相关题目
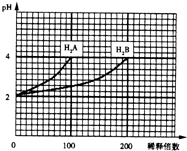 常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1ml,分别加水稀释,测得PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A、H2A为二元弱酸 |
| B、PH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) |
| C、含NaHA、NaHB的混合溶液中,离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) |
| D、Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+) |
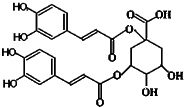 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
某无色溶液中只可能含有①Na+、②Ba2+、③Cl一、④I一、⑤SO32一、⑥SO42一 离子中的若干种(忽略水电离出的H+、OH一),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表.下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
| ③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、不能确定的离子是③⑥ |
| D、可能含有的离子是①⑥ |
下列叙述错误的是( )
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |
下列叙述中正确的是( )
| A、乙醇和丙三醇互为同系物 |
| B、16gCH4和18gNH4+所含的质子数相等 |
| C、32S和33S的核外电子数相等,属于同一种核素 |
| D、质量相等,体积不等的CO和C2H4的分子数相等 |
以下对生活事实的解释,不正确的是( )
| A、厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解 |
| B、2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| C、用加酶洗衣粉在温水中不能洗涤毛料服装 |
| D、将实验室的废酸液和废碱液中和后再排放符合“绿色化学”的要求 |
