题目内容
5.下列反应为氧化还原反应,且氧化剂和还原剂为同种物质的是( )| A. | SO2+Cl2+2H2O=H2SO4+2HCl | B. | 3CO2+4NaOH=2NaHCO3+Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | D. | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
分析 含元素化合价变化的反应为氧化还原反应,且同种物质中元素的化合价有升有降,则氧化剂和还原剂为同种物质,以此来解答.
解答 解:A.S元素的化合价升高,还原剂是SO2,Cl元素的化合价降低,则氧化剂是Cl2,故A不选;
B.无元素的化合价变化,为非氧化还原反应,故B不选;
C.无元素的化合价变化,为非氧化还原反应,故C不选;
D.NO2中N元素由+4价变为+2价和+5价,即是氧化剂又是还原剂,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意常见元素的化合价,题目难度不大.

练习册系列答案
相关题目
16.下列叙述中,正确的是( )
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | 碱性介质甲烷燃料电池的正极反应为:O2+2H2O+4e-═4OH- | |
| C. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| D. | 氯碱工业中阳极上产生的气体比阴极上产生的气体多 |
20.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应:2Na+H2O=2Na++OH-+H2↑ | |
| B. | 氯化镁溶液中加入氨水:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+=2Cl-+2Fe3+ |
10.下列说法不正确的是( )
| A. | 乙烯、乙炔、乙醛都能使溴水或酸性KMnO4溶液褪色 | |
| B. | 可用加入NaOH溶液并加热,通过观察油层是否消失或变薄来鉴别苯和乙酸乙酯 | |
| C. | 可用H2SO4溶液、银氨溶液和碘水来检验淀粉液是否部分水解 | |
| D. | 油脂在热NaOH溶液中完全水解后,加入饱和食盐水,可观察到液面上有固体析出 |
17.乙醇和乙酸是生活中两种常见的有机物.下列有关说法不正确的是( )
| A. | 乙醇和乙酸都能杀菌消毒 | B. | 乙醇和乙酸都是电解质 | ||
| C. | 乙醇和乙酸都能发生酯化反应 | D. | 乙醇和乙酸都能与活泼金属反应 |
14.下列离子方程式中书写正确的是( )
| A. | 将Na2O2固体加入水中:Na2O2+2H2O=2Na++2OH-+O2↑ | |
| B. | Ba(OH)2溶液与硫酸的反应:OH-+H+=H2O | |
| C. | Cl2溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 少量CO2通入澄清石灰水中:CO2+2OH-+Ca2+═Ca CO3↓+2H2O |
10.对于反应N2O4(g)?2NO2(g)△H>0,要使该反应的平衡常数值增大,可以采取的措施有( )
| A. | 增大N2O4的浓度 | B. | 增大NO2的浓度 | C. | 升高体系的温度 | D. | 减小压强 |
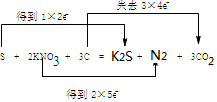 (同时用双线桥表示电子的得失)
(同时用双线桥表示电子的得失)