题目内容
10.对于反应N2O4(g)?2NO2(g)△H>0,要使该反应的平衡常数值增大,可以采取的措施有( )| A. | 增大N2O4的浓度 | B. | 增大NO2的浓度 | C. | 升高体系的温度 | D. | 减小压强 |
分析 影响平衡常数的因素只有温度,如使平衡常数增大,平衡应正向移动,以此解答该题.
解答 解:浓度、压强不影响平衡常数,正反应为吸热反应,如升高温度,则平衡正向移动,平衡常数增大.
故选C.
点评 本题考查化学平衡的移动问题,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意平衡常数只与温度有关,把握影响化学平衡移动的因素.

练习册系列答案
相关题目
5.下列反应为氧化还原反应,且氧化剂和还原剂为同种物质的是( )
| A. | SO2+Cl2+2H2O=H2SO4+2HCl | B. | 3CO2+4NaOH=2NaHCO3+Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | D. | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
1.下列溶液中c(Cl-)与50mL 1mol•L-1AlCl3溶液中c(Cl-)相等的是( )
| A. | 75 mL 1.5 mol•L-1的MgCl2溶液 | B. | 75 mL 4 mol•L-1的NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 150 mL 1 mol•L-1的NaCl溶液 |
18.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )
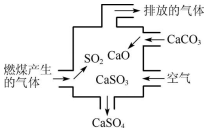

| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内只发生了化合反应 | |
| C. | 总反应可表示为2SO2+2CaCO3+O2?2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含有SO2 |
15.物质的量浓度相同的NaCl、MgCl 2、AlCl 3 三种溶液,当溶液的体积比为1:2:3时,用相同物质的量浓度的AgNO3 溶液将Cl-完全沉淀,则需AgNO3溶液的体积比为( )
| A. | 1:1:1 | B. | 3:4:3 | C. | 1:4:9 | D. | 1:2:3 |
19.下列叙述正确的是( )
| A. | 溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为:CH3OH-6e-+8OH-=CO32-+6H2O | |
| C. | 在铁上镀铜时,金属铜作阴极 | |
| D. | 电解法精炼铜时,电解质溶液中铜离子浓度一定不变 |
20.下列说法不正确的是( )
| A. | 氯气是一种重要的化工原料,广泛应用于自来水的消毒和农药的生产等方面 | |
| B. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| C. | 用二氧化硅制造的光导纤维具有很强的导电能力,可用于制作光缆 | |
| D. | 化肥的生产、金属矿石的处理、金属材料的表面清洗等都可能用到硫酸 |
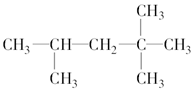 2,2,4-三甲基戊烷
2,2,4-三甲基戊烷 3,4-二甲基己烷
3,4-二甲基己烷