题目内容
13.金属及其化合物在生产和生活中有广泛的用途.请按要求填写:(1)制造电路板工艺中,用FeC13溶液刻蚀铜箔,反应原理是Cu+2Fe3+═2Fe2++Cu2+(用离子方程式表示)
(2)胃舒平(复方氢氧化铝)可以治疗胃酸过多,反应原理是Al(OH)3+3H+=Al3++3H2O(用离子方程式表示)
(3)硫酸亚铁缓释片可以补铁、防治贫血.在酸性环境下很容易变质.其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示)
(4)碳酸氢钠可作发酵粉,用化学方程式表示其原因NaHCO3+HCl=NaCl+CO2↑+H2O
(5)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时产生N2、CO2气体和一种含硫物质,其化学方程式
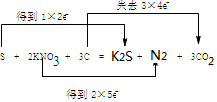 (同时用双线桥表示电子的得失)
(同时用双线桥表示电子的得失)
分析 (1)FeCl3具有氧化性,可与铜发生氧化还原反应,以此解答;
(2)氢氧化铝和胃酸反应生成氯化铝和水;
(3)酸性溶液中氧气可以氧化亚铁离子为铁离子;
(4)碳酸氢钠和酸反应生成二氧化碳;
(5)S+2KNO3+3C═K2S+N2↑+3CO2↑中,S、N元素的化合价降低,C元素的化合价升高,该反应转移12e-,以此来解答;
解答 解:(1)FeCl3具有氧化性,可与铜发生氧化还原反应生成CuCl2和FeCl2,反应的化学方程式为Cu+2FeCl3═2FeCl2+CuCl2,离子方程式为:Cu+2Fe3+═2Fe2++Cu2+,
故答案为:Cu+2Fe3+═2Fe2++Cu2+;
(2)治疗胃酸过多原理是:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)硫酸亚铁缓释片可以补铁、防治贫血.在酸性环境下很容易变质,其原因是4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(4)碳酸氢钠无毒且能与酸反应生成二氧化碳气体,气体受热膨胀使面松软多孔,对人体无害,反应的化学方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O,
故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O
(5)S、N元素的化合价降低,C元素的化合价升高,该反应转移12e-,则用双桥法标出电子转移的方向及数目为 ,
,
故答案为: ;
;
点评 本题考查物质性质和应用、氧化还原反应及其离子方程式、化学方程式书写,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、转移电子及分析与应用能力的考查,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
4.用试剂制备下列气体和性质实验中,由现象得出的结论错误的是( )
| 选项 | 试剂 | 试纸或试液或气体 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 湿润的红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 亚硫酸钠、浓硫酸 | 澄清石灰水溶液 | 溶液先变浑浊后又澄清 | 溶解度CaSO3大于Ca(HSO3)2 |
| C | 浓盐酸、MnO2加热 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
| D | 稀硝酸、铜 | 产生无色气体通入空气 | 气体变为红棕色 | 无色气体为NO |
| A. | A | B. | B | C. | C | D. | D |
8.氢气、甲烷、乙醇均可设计成燃料电池.下列有关燃料电池的说法错误的是( )
| A. | 氢气、甲烷、乙醇在燃料电池中作负极材料 | |
| B. | 氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物可回收利用 | |
| C. | 碱性介质下的乙醇燃料电池负极反应为:C2H5OH-12e-═2CO2↑+3H2O | |
| D. | 碱性介质下甲烷燃料电池的正极反应为:O2+2H2O+4e-═4OH |
18.室温下,0.01mol/L二元酸H2A溶液的pH=3,下列说法正确的是( )
| A. | 该溶液中由水电离出的c(H+)为1.0×10-3mol/L | |
| B. | 在Na2A、NaHA两种溶液中,离子种类不同 | |
| C. | 在NaHA溶液中一定有c(OH-)+c(HA-)+2c(A2-)═c(Na+)+c(H+) | |
| D. | 在Na2A溶液中,c(Na+)>c(HA-)>c(A2-)>c(OH-)>c(H+) |
5.下列反应为氧化还原反应,且氧化剂和还原剂为同种物质的是( )
| A. | SO2+Cl2+2H2O=H2SO4+2HCl | B. | 3CO2+4NaOH=2NaHCO3+Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | D. | 2NO2+2NaOH=NaNO2+NaNO3+H2O |
2.常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是( )
| A. | 一定浓度的CH3COONa溶液 | B. | 一定浓度的氨水溶液 | ||
| C. | 一定浓度的NaHSO4溶液 | D. | pH等于5的醋酸溶液 |
18.如图为某燃煤电厂处理废气的装置示意图,下列说法错误的是( )
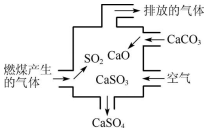

| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内只发生了化合反应 | |
| C. | 总反应可表示为2SO2+2CaCO3+O2?2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含有SO2 |
 2,3-二甲基戊烷
2,3-二甲基戊烷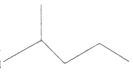 表示的分子式C6H14;
表示的分子式C6H14;
 .
.