题目内容
表示下列反应的离子方程式中,正确的是( )
| A、向稀盐酸中滴加AgNO3溶液:Ag++HCl═AgCl↓+H+ |
| B、向醋酸溶液中滴加NaOH溶液:OH-+H+═H2O |
| C、向固体BaCO3中滴加稀硝酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合:Al3++4OH-═AlO2-+2 H2O |
考点:离子方程式的书写
专题:
分析:A.氯化氢为强电解质,应拆成离子;
B.醋酸为弱电解质,应保留化学式;
C.碳酸钡与盐酸反应生成氯化钡、二氧化碳和水;
D.相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合,氢氧化钠不足,反应生成氢氧化铝和氯化钠.
B.醋酸为弱电解质,应保留化学式;
C.碳酸钡与盐酸反应生成氯化钡、二氧化碳和水;
D.相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合,氢氧化钠不足,反应生成氢氧化铝和氯化钠.
解答:
解:A.向稀盐酸中滴加AgNO3溶液,离子方程:Ag++Cl-═AgCl↓,故A错误;
B.向醋酸溶液中滴加NaOH溶液,离子方程式:OH-+CH3COOH═H2O+CH3COO-,故B错误;
C.向固体BaCO3中滴加稀硝酸,离子方程式:BaCO3+2H+═Ba2++H2O+CO2↑,故C正确;
D.相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合,离子方程式:Al3++3OH-═Al(OH)3↓,故D错误;
故选:C.
B.向醋酸溶液中滴加NaOH溶液,离子方程式:OH-+CH3COOH═H2O+CH3COO-,故B错误;
C.向固体BaCO3中滴加稀硝酸,离子方程式:BaCO3+2H+═Ba2++H2O+CO2↑,故C正确;
D.相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合,离子方程式:Al3++3OH-═Al(OH)3↓,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分及反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
常温下,将足量CaCO3加入下列各体系中,溶解度最大的是( )
| A、10mL水 |
| B、10mL 0.1mol/LCaCl2溶液 |
| C、20mL 0.1mol/LNaHSO4 |
| D、40mL 0.1mol/LNa2CO3溶液 |
分别在pH=1的酸和pH=13的NaOH溶液中加入足量的铝,放出的H2的量前者多,其原因可能是( )
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
①酸溶液的体积大于NaOH溶液的体积 ②两溶液的体积相同,酸是多元强酸
③酸是强酸,浓度比NaOH溶液的大 ④两溶液的体积相同,酸是一元弱酸.
| A、①④ | B、④ | C、②③ | D、③ |
关于铜-锌-稀硫酸构成的原电池的有关叙述正确的是( )
| A、锌为负极,锌发生还原反应Zn-2e-=Zn2+ |
| B、电流方向经外电路由锌到铜 |
| C、工作时SO42-离子向正极移动 |
| D、外电路电子流入的一极为正极,电子流出的一极为负极 |
在2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+D(g),若最初加入的A和B都是4mol,在前10s内A的平均反应速率为0.12mol?L-1?s-1,则10s时,容器内B的物质的量为( )
| A、3.6 mol |
| B、3.2 mol |
| C、2.4 mol |
| D、1.2 mol |
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
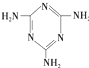 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有