题目内容
关于铜-锌-稀硫酸构成的原电池的有关叙述正确的是( )
| A、锌为负极,锌发生还原反应Zn-2e-=Zn2+ |
| B、电流方向经外电路由锌到铜 |
| C、工作时SO42-离子向正极移动 |
| D、外电路电子流入的一极为正极,电子流出的一极为负极 |
考点:原电池和电解池的工作原理
专题:
分析:Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,溶液中阳离子向正极移动,阴离子向负极移动.
解答:
解:A、Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,Zn-2e-=Zn2+,故A错误;
B、电子从负极锌片沿导线流向正极铜片,电流方向经外电路由Cu到Zn,故B错误.
C、溶液中阳离子向正极移动,阴离子向负极移动,SO42-离子向负极移动,故C错误;
D、原电池中,电子流入的一极为正极,电子流出的一极为负极,故D正确.
故选D.
B、电子从负极锌片沿导线流向正极铜片,电流方向经外电路由Cu到Zn,故B错误.
C、溶液中阳离子向正极移动,阴离子向负极移动,SO42-离子向负极移动,故C错误;
D、原电池中,电子流入的一极为正极,电子流出的一极为负极,故D正确.
故选D.
点评:本题考查了原电池原理,难度不大,注意把握正负极的判断方法,难点是判断溶液中阴阳离子的移动方向.

练习册系列答案
相关题目
A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极.A、B、C金属的活动性顺序为( )
| A、B>A>C |
| B、A>C>B |
| C、A>B>C |
| D、B>C>A |
表示下列反应的离子方程式中,正确的是( )
| A、向稀盐酸中滴加AgNO3溶液:Ag++HCl═AgCl↓+H+ |
| B、向醋酸溶液中滴加NaOH溶液:OH-+H+═H2O |
| C、向固体BaCO3中滴加稀硝酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合:Al3++4OH-═AlO2-+2 H2O |
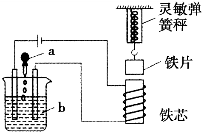 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |
如图是铜锌原电池示意图.当该原电池工作时,下列描述不正确的是( )


| A、溶液逐渐变蓝 |
| B、锌片逐渐溶解 |
| C、铜片上有气泡产生 |
| D、电流计指针发生偏转 |
炽热的炉膛内有反应:C(s)+O2(g)=CO2(g)△H=-392kJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ/mol,CO(g)+
O2(g)=CO2(g)△H=-282kJ,H2(g)+
O2(g)=H2O(g)△H=-241kJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、不能节省燃料,但能使炉火瞬间更旺 |
| B、虽不能使炉火更旺,但可以节省燃料 |
| C、既能使炉火更旺,又能节省燃料 |
| D、既不能使炉火更旺,又不能节省燃料 |
如图是元素周期表短周期的一部分.其中F原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列说法不正确的是( )
| A | B | C | |
| D | E | F |
| A、D的单质是常见的半导体材料 |
| B、B与E形成的化合物不只一种 |
| C、C与F的原子序数之差一定为8 |
| D、A的最高价氧化物的水化物能和Al2O3反应 |