题目内容
在2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+D(g),若最初加入的A和B都是4mol,在前10s内A的平均反应速率为0.12mol?L-1?s-1,则10s时,容器内B的物质的量为( )
| A、3.6 mol |
| B、3.2 mol |
| C、2.4 mol |
| D、1.2 mol |
考点:反应速率的定量表示方法
专题:
分析:10s后达到平衡,若A的平均速率是0.12mol/(L?s),则消耗A的物质的量为2L×10s×0.12mol/(L?s)=2.4mol,结合反应的化学方程式利用三段式法计算.
解答:
解:前10s A的平均反应速率为0.12mol/(L?s),
由反应速率之比等于化学计量数之比可知,
B的反应速率为0.12mol/(L?s)×
=0.04mol/(L?s),
所以转化的B为0.04mol/(L?s)×10s×2L=0.8mol,
则10s时,容器中B的物质的量为4mol-0.8mol=3.2mol,
故选B.
由反应速率之比等于化学计量数之比可知,
B的反应速率为0.12mol/(L?s)×
| 1 |
| 3 |
所以转化的B为0.04mol/(L?s)×10s×2L=0.8mol,
则10s时,容器中B的物质的量为4mol-0.8mol=3.2mol,
故选B.
点评:本题考查化学反应速率的计算,明确反应速率的计算公式和反应速率与化学计量数的关系即可解答,注意利用三段式法计算较为直观,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
表示下列反应的离子方程式中,正确的是( )
| A、向稀盐酸中滴加AgNO3溶液:Ag++HCl═AgCl↓+H+ |
| B、向醋酸溶液中滴加NaOH溶液:OH-+H+═H2O |
| C、向固体BaCO3中滴加稀硝酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合:Al3++4OH-═AlO2-+2 H2O |
如图是元素周期表短周期的一部分.其中F原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列说法不正确的是( )
| A | B | C | |
| D | E | F |
| A、D的单质是常见的半导体材料 |
| B、B与E形成的化合物不只一种 |
| C、C与F的原子序数之差一定为8 |
| D、A的最高价氧化物的水化物能和Al2O3反应 |
可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是( )
| A、氯化铁溶液 溴水 |
| B、碳酸钠溶液 溴水 |
| C、酸性高锰酸钾溶液 溴水 |
| D、酸性高锰酸钾溶液 氯化铁溶液 |
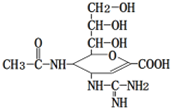 “甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )
“甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |
可逆反应2NO2?2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的.比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的.比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A、①③⑤ | B、②③⑤ |
| C、①③④ | D、①②③④⑤ |
某研究性学习小组借助如图所示的仪器装置完成收集NO气体的实验.正确的操作是( )


| A、从①口进气,用排水法集气 |
| B、从①口进气,用排气法集气 |
| C、从②口进气,用排水法集气 |
| D、从②口进气,用排气法集气 |
 在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.