题目内容
常温下,将足量CaCO3加入下列各体系中,溶解度最大的是( )
| A、10mL水 |
| B、10mL 0.1mol/LCaCl2溶液 |
| C、20mL 0.1mol/LNaHSO4 |
| D、40mL 0.1mol/LNa2CO3溶液 |
考点:溶解度、饱和溶液的概念
专题:
分析:如果溶剂中含有和电离平衡正反应产物相同的离子,则发生同离子效应,抑制电离平衡,从而抑制溶解平衡.
解答:
解:CaCO3的溶解过程如下:CaCO3(s)?Ca2++CO32-,如果溶液中有大量Ca2+ 或大量CO32-,都会使平衡左移,减小CaCO3的溶解度,这就是同离子效应,故CaCl2溶液、Na2CO3溶液均抑制碳酸钙的溶解,而NaHSO4电离出氢离子,氢离子与碳酸根结合生成二氧化碳气体放出,促进碳酸钙的溶解,
故选C.
故选C.
点评:本题考查同离子效应,难度不大,注意如果溶剂中含有和电离平衡正反应产物相同的离子,则发生同离子效应,抑制电离平衡,从而抑制溶解平衡.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
下列有关原子结构、元素性质的说法正确的是( )
| A、Si、P、S、Cl元素的单质与氢气化合越来越容易 |
| B、元素原子最外层电子数越多,元素金属性越强 |
| C、元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族 |
| D、F-、O2-、Mg2+、Na+离子半径逐渐减小 |
表示下列反应的离子方程式中,正确的是( )
| A、向稀盐酸中滴加AgNO3溶液:Ag++HCl═AgCl↓+H+ |
| B、向醋酸溶液中滴加NaOH溶液:OH-+H+═H2O |
| C、向固体BaCO3中滴加稀硝酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、相同物质的量浓度的AlC13溶液与NaOH溶液等体积混合:Al3++4OH-═AlO2-+2 H2O |
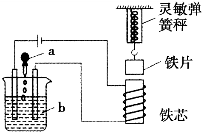 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |
炽热的炉膛内有反应:C(s)+O2(g)=CO2(g)△H=-392kJ/mol,往炉膛内通入水蒸气时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ/mol,CO(g)+
O2(g)=CO2(g)△H=-282kJ,H2(g)+
O2(g)=H2O(g)△H=-241kJ/mol,由以上反应推断往炽热的炉膛内通入水蒸气时( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、不能节省燃料,但能使炉火瞬间更旺 |
| B、虽不能使炉火更旺,但可以节省燃料 |
| C、既能使炉火更旺,又能节省燃料 |
| D、既不能使炉火更旺,又不能节省燃料 |
 “甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )
“甲型H7N9”流感疫情已构成“具有国际影响的公共卫生紧急事态”.已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性,其分子结构如图所示.下列说法正确的是( )| A、该物质的分子式为C12H19N4O7 |
| B、1mol该物质与NaOH溶液反应,可以消耗4molNaOH |
| C、在一定条件下,该物质可以发生消去、加成、取代等反应 |
| D、该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应 |