题目内容
3.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )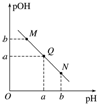
| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
分析 酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合弱电解质的电离解答该题.
解答 解:A.M点主要是醋酸,Q点主要是醋酸钠,由于醋酸是弱酸,电离程度很小,离子浓度也较小,所以M点所示溶液的导电能力弱于Q点,故A错误;
B.N点所示溶液为碱性,则c(OH-)>c(H+),根据溶液电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),可判断出此时c(Na+)>c(CH3COO-),故B错误;
C.氢离子或氢氧根离子均能抑制水的电离,氢离子或氢氧根离子浓度越大对水的电离程度越大,当醋酸与氢氧化钠恰好反应生成醋酸钠时,水的电离程度最大,此时溶液显碱性,故C错误;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性.则所加NaOH溶液体积略小于醋酸溶液的体积,故D正确.
故选D.
点评 本题考查酸碱中和的定性判断和计算,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
13.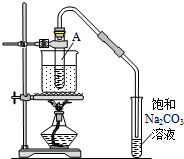 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
 按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )
按如图所示装置,在试管A里加入3mL乙醇和2mL冰醋酸,然后一边摇动,一边慢慢地加入2mL浓硫酸,再加入少量碎瓷片,用酒精灯加热10min,结果在饱和碳酸钠溶液的液面上没有无色油状液体,下列对其原因的分析错误的是( )| A. | 试管A中没有发生反应 | |
| B. | 热源小、水量多,水浴升温速度太慢 | |
| C. | 产物蒸汽在试管A上部全部被冷凝回流 | |
| D. | 产物已全部溶解在饱和Na2CO3溶液中 |
14.下表是几种常见弱酸的电离平衡常数(25℃)
回答下列问题:
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大,电离程度越大,酸性越强;
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是H3PO4,最弱的是HPO42-;
(4)H3PO4的Ka1、Ka2、Ka3之间存在数量上的规律,此规律是在数值上相差很大,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
| 酸 | 电离方程式 | 电离常数 K/mol•L-1 |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.26×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?K值越大,电离程度越大,酸性越强;
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是H3PO4,最弱的是HPO42-;
(4)H3PO4的Ka1、Ka2、Ka3之间存在数量上的规律,此规律是在数值上相差很大,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
11.常温时,向pH=2的硫酸溶液中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( )
| A. | pH=12的Ba(OH)2 | B. | pH=12的NH3•H2O | ||
| C. | 0.05 mol/L的NaOH | D. | 0.05 mol/L的BaCl2 |
18.在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
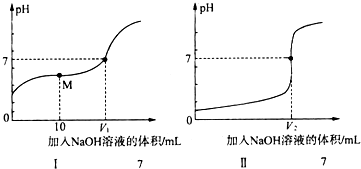
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1<V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀、溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:

①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1<V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀、溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
13.下列物质属于可溶性的是( )
| A. | Fe(OH)3 | B. | Cu(OH)2 | C. | Al(OH)3 | D. | Ba(OH)2 |
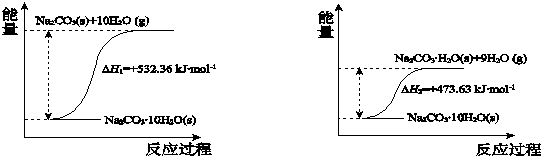
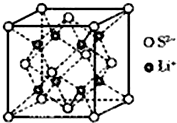 硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题:
硫的单质及其化合物在工农业生产中的用途非常广泛.回答下列问题: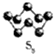 )易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.
)易溶于CS2,固态时属于分子晶体,其中硫原子杂化轨道类型为sp3.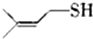 ).
).