题目内容
18.在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
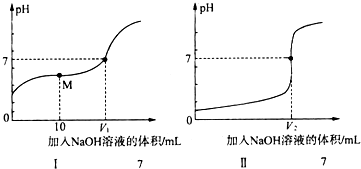
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1<V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀、溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
分析 (1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大;
②酸和碱都对水的电离起抑制作用,酸、碱性越强,水的电离程度越小;
③醋酸钠显示碱性,氯化钠显示中性;
④0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,据此确定离子浓度大小;
(2)①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是AgSCN存在溶解平衡;
②银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,反应可表示为AgSCN(s)+I-=AgI+SCN-(aq),以此书写平衡常数.
解答 解:(1)①由图中未加NaOH时的pH可知,图Ⅰ中酸的pH大于1,图Ⅱ中酸的pH=1,说明Ⅱ为0.1mol/L的盐酸溶液,为醋酸溶液滴定过程,所以滴定醋酸的曲线是I,
故答案为:I;
②0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1醋酸溶液,故答案为:CH3COOH;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2,故答案为:<;
④用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(2)①铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-?Fe(SCN)3,步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是AgSCN存在溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-,
故答案为:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-;
②加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,且溶液红色变浅,
故答案为:出现白色沉淀;溶液红色变浅;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,反应可表示为AgSCN(s)+I-=AgI+SCN-(aq),则K=$\frac{c(SC{N}^{-})}{c({I}^{-})}$,
故答案为:$\frac{c(SC{N}^{-})}{c({I}^{-})}$.
点评 本题综合考查学生酸碱滴定、沉淀溶解平衡的移动以及溶液中离子浓度大小比较的知识,为高频考点,侧重于学生的分析能力和计算能力的考查,属于综合知识的考查,图象分析判断是解题关键,难度中等.

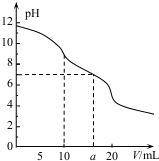 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
| A. | 8种 | B. | 12种 | C. | 15种 | D. | 20种 |
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
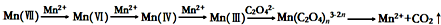
上述实验中,实验Ⅰ可证明这个历程是可信的.
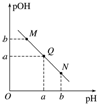
| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
| A. | pH=3的HNO3与pH=11的KOH溶液 | |
| B. | pH=3的HNO3与pH=11的氨水 | |
| C. | pH=3的H2SO4与pH=11的NaOH | |
| D. | pH=3的CH3COOH 与pH=11的Ba(OH)2溶液 |
 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
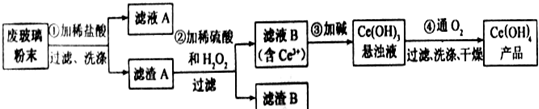
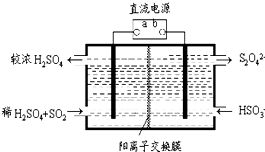 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.