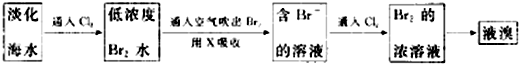
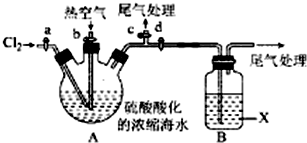
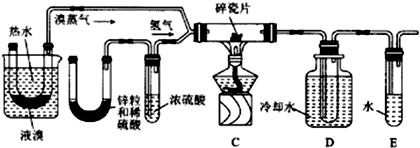
题目内容
12.某强碱性溶液中可能含有K+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:①取少量溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
原溶液中肯定不存在的离子是SO42-、SiO32-、Al3+,肯定存在的离子是K+、AlO2-、CO32-.
分析 强碱性溶液中一定不存在Al3+,
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成,则一定不含有SO42-和SiO32-,可能含有CO32-离子;
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,则一定含有AlO2-,根据实验的现象和离子共存知识确定存在的离子和一定不存在的离子.
解答 解:强碱性溶液中一定不存在Al3+,
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成,则一定不含有SO42-和SiO32-,可能含有CO32-离子;
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,和偏铝酸根反应产生氢氧化铝沉淀,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,是盐酸将氢氧化铝全部溶解,所以一定含有偏铝酸根离子,沉淀量基本不变后产生的一种气体只能为二氧化碳,即一定含有碳酸根离子,根据电中性原理,确定一定含有K+;
故答案为:SO42-、SiO32-、Al3+;K+、AlO2-、CO32-.
点评 本题考查离子检验,为高频考点,明确离子性质及离子之间反应是解本题关键,侧重考查学生分析推断能力,注意排除干扰离子,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
3.某温度下,向一定体积0.1mol•L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )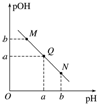

| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
7.某有机物分子中有 n 个CH 2,m 个 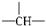 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
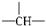 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
17.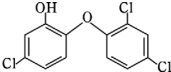 一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
 一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )| A. | 该物质苯环上的一溴取代物有 6 种 | |
| B. | 该物质与 FeCl3溶液混合后不显色 | |
| C. | 该物质中所有原子一定处于同一平面 | |
| D. | 物质的分子式为 C12H6Cl3O2 |
4.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
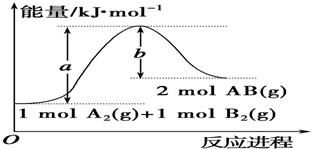

| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应吸收热量 (a-b)kJ | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1mol A-A和1mol B-B键,放出a kJ能量 |
1.某元素R原子的质量数为127,已知R的离子中含有72个中子,54个电子,该原子最高价某化合物的化学式正确的是( )
| A. | ROH | B. | R2O7 | C. | HRO3 | D. | NaR |
2.下列物质是最常见的温室气体( )
| A. | O2 | B. | H2 | C. | CO2 | D. | Cl2 |
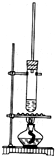 已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)
已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)