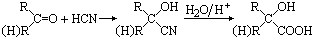题目内容
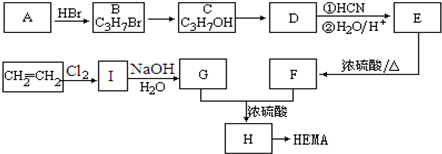
 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
(1)C、D、G三个装置所盛放的试剂分别是:
C
(2)E中的现象为
(3)写出在A、E、G中发生反应的化学方程式为:A:
考点:氯气的实验室制法
专题:
分析:(1)实验制备氯气中含杂质气体氯化氢和水蒸气,通入E装置时需要除去杂质,所以通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;氯气有毒不能排到大气中,要进行尾气吸收;
(2)氯气和铁在点燃条件下剧烈反应生成氯化铁,产生棕褐色烟,放热;
(3)A中是二化锰和浓盐酸加热反应生成氯化锰、氯气和水,G中是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,E中是氯气和铁反应生成氯化铁.
(2)氯气和铁在点燃条件下剧烈反应生成氯化铁,产生棕褐色烟,放热;
(3)A中是二化锰和浓盐酸加热反应生成氯化锰、氯气和水,G中是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,E中是氯气和铁反应生成氯化铁.
解答:
解:(1)实验制备的氯气中通常含杂质HCl气体和水蒸气,通入E装置时需要除去HCl,氯气在饱和食盐水中溶解度较小,所以通过饱和食盐水除去氯气中的杂质HCl,然后通过干燥剂浓H2SO4除去水蒸气;氯气有毒不能排到大气中,最后还需要进行尾气吸收,可以用NaOH溶液吸收多余的氯气,
故答案为:饱和食盐水;浓H2SO4;NaOH溶液;
(2)氯气和铁反应生成氯化铁产生棕褐色烟,剧烈反应放热,故答案为:产生棕黑色(棕褐色)的烟,FeCl3;
(3)A中是二化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓盐酸)
MnCl2+Cl2↑+2H2O,G中是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,E中是氯气和铁反应生成氯化铁,化学反应方程式为:2Fe+3Cl2
2FeCl3,故答案为:MnO2+4HCl(浓盐酸)
MnCl2+Cl2↑+2H2O;2Fe+3Cl2
2FeCl3;Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:饱和食盐水;浓H2SO4;NaOH溶液;
(2)氯气和铁反应生成氯化铁产生棕褐色烟,剧烈反应放热,故答案为:产生棕黑色(棕褐色)的烟,FeCl3;
(3)A中是二化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓盐酸)
| ||
| ||
| ||
| ||
点评:本题考查了氯气的实验室制备原理、装置、杂质气体的处理、反应现象的分析判断、化学方程式的书写等知识,题目难度中等,主要是氯气及其化合物性质的应用,试题有利于提高学生的分析、理解能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
不需要其它试剂,只有几只试管和滴管而不能相互鉴别的物质组是( )
| A、氯化钡溶液和碳酸钠溶液 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、偏铝酸钠溶液和稀硫酸 |
| D、碳酸钠溶液和稀盐酸 |
下列离子方程式不正确的是( )
| A、向氢氧化钾溶液中滴加少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| B、在亚硫酸中加入过量的次氯酸钠溶液 H2SO3+3ClO-=Cl-+2HClO+SO42- |
| C、在稀HNO3溶液加入FeS固体 FeS+2H+=Fe2++H2S↑ |
| D、在过氧化钠中加入稀硫酸 2Na2O2+4H+=4Na++2H2O+O2↑ |
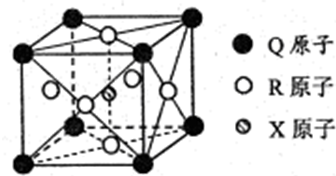
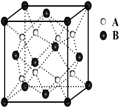 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题: