题目内容
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和.另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题.
(1)微粒XZ32-的中心原子杂化类型为 化合物YW3的空间构型为
(2)R基态原子的电子排布式为 ,元素X、Y、Z的第一电离能由大到小的顺序为
(用元素符号表示).
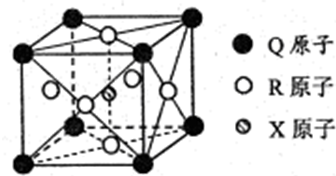
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为 ,其中一个Q原子紧邻 个R原子.
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子,该反应的离子方程式是 ,弱酸HXY分子中存在的键与键的数目之比为 .

(1)微粒XZ32-的中心原子杂化类型为
(2)R基态原子的电子排布式为
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子,该反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大.X基态原子核外电子分布在3个能级,各能级电子数相等,其电子排布为1s22s22p2,则X为C;
Z是地壳中含量最多的元素,则Z为O,所以Y为N;
W是电负性最大的元素,则W为F;
元素Q的核电荷数等于Y、W原子最外层电子数之和,则Q的核电荷数为5+7=12,则Q为Mg;
另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子,电子排布为1s22s22p63s23p63d84s2,则R为Ni元素,以此来解答各小题即可.
Z是地壳中含量最多的元素,则Z为O,所以Y为N;
W是电负性最大的元素,则W为F;
元素Q的核电荷数等于Y、W原子最外层电子数之和,则Q的核电荷数为5+7=12,则Q为Mg;
另有R元素位于周期表第4周期第VIII族,价层电子中有两个未成对电子,电子排布为1s22s22p63s23p63d84s2,则R为Ni元素,以此来解答各小题即可.
解答:
解:依据分析可知:X为碳、Y为氮、Z为氧、W为氟、Q为镁、R为镍,
(1)微粒CO32-的中心原子价电子数4+
=4,为sp3杂化,化合物NF3的空间构型与氨气相似,为三角锥形,故答案为:sp3;三角锥形;
(2)R的原子序数为28,其基态原子电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,N的2p电子半满为稳定结构,非金属性强的第一电离能大,则元素X、Y、Z的第一电离能由大到小的顺序为N>O>C,故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;N>O>C;
(3)Mg位于顶点,个数为8×
=1,C位于体心,个数为1,Ni位于面心,个数为6×
=3,则晶体的化学式为MgCNi3或Mg Ni3C,Q与R最近距离在面上,1个Q紧邻R原子的个数为3×8×
=12,故答案为:MgCNi3或Mg Ni3C;12;
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-,弱酸HXY分子,结构式为H-C≡N,单键为σ键,三键中有1个σ键、2个π键,则存在的σ键与π键的数目之比为1:1,
故答案为:Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-;1:1.
(1)微粒CO32-的中心原子价电子数4+
| 4+2-2×3 |
| 2 |
(2)R的原子序数为28,其基态原子电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,N的2p电子半满为稳定结构,非金属性强的第一电离能大,则元素X、Y、Z的第一电离能由大到小的顺序为N>O>C,故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;N>O>C;
(3)Mg位于顶点,个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-,弱酸HXY分子,结构式为H-C≡N,单键为σ键,三键中有1个σ键、2个π键,则存在的σ键与π键的数目之比为1:1,
故答案为:Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-;1:1.
点评:本题考查较综合,涉及元素的推断、晶胞计算、电子排布等,注重高频考点的训练,侧重位置、结构、性质及原子结构与晶体的分析与推断能力的综合考查,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组关于强电解质、弱电解质、非电解质的归类正确的是( )
| 选项 | A | B | C | D |
| 强电解质 | 石墨 | NaCl | CaCO3 | HNO3 |
| 弱电解质 | 醋酸 | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | 酒精 | Na2O |
| A、A | B、B | C、C | D、D |
下列说法中正确的是( )
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的是( )
| A、用盐酸除去BaSO4中混有的少量BaCO3 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| B、从食盐水中获得NaCl晶体酒精灯、玻璃棒、坩埚、泥三角 |
| C、用0.l0mol?L-1的盐酸测定未知浓度的NaOH溶液 碱式滴定管、酸式滴定管、锥形瓶、烧杯 |
| D、用溴水和CCl4除去NaBr溶液中少量NaI 烧杯、玻璃棒、胶头滴管、分液漏斗 |

 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
 .
.

