题目内容
19.有关糖类物质概念的叙述中,正确的是( )| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是人体必需的营养素 | |
| C. | 葡萄糖是一种多羟基醛,不具有还原性 | |
| D. | 糖类是具有Cn(H2O)m通式的物质,糖也称为碳水化合物 |
分析 糖类为多羟基醛或多羟基酮,为人体必需的影响物质,糖类并不一定有甜味,以此解答该题.
解答 解:A.糖类不一定有甜味,如淀粉,纤维素,故A错误;
B.糖类可在人体内氧化生成二氧化碳和水,并释放出能量,为人体必需的营养素,故B正确;
C.葡萄糖为多羟基醛,含有醛基,具有还原性,故C错误;
D.糖类的通式不一定符合Cn(H2O)m通式,如鼠李糖,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的双基的考查,有利于培养学生良好的科学素养,提高学习的极性键,注意把握糖类的分类和性质,难度不大.

练习册系列答案
相关题目
7.下列对该溶液的叙述不正确的是( )
| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
4.下列物质在水溶液中的电离方程式书写错误的是( )
| A. | Fe2(SO4)3═2Fe3++3SO42- | B. | KClO3═K++Cl-+O32- | ||
| C. | KAl(SO4)2═K++Al3++2SO42- | D. | NaHSO4═Na++H++SO42- |
11.下列反应既是吸热反应,又是氧化还原反应的是( )
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |
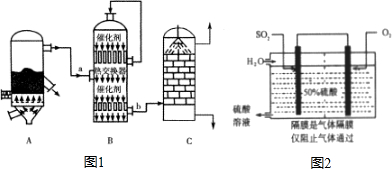 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题: