题目内容
7.下列对该溶液的叙述不正确的是( )| A. | 已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时可判定该溶液呈中性 | |
| B. | pH=5的H2SO4溶液,加水稀释到500倍,则稀释后c(H+)与c(SO42-)的比为2:1 | |
| C. | 某温度下,水的离子积常数Kw=10-12,该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为9:1 | |
| D. | 将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为11:1 |
分析 A.温度T时水的离子积常数为KW,根据c(H+)•c(OH-)=KW,c(H+)=$\frac{{K}_{W}}{c(OH-)}$,当c(H+)=$\sqrt{{K}_{W}}$mol•L-1时,说明c(H+)=c(OH-);
B.由溶液pH=5,计算原溶液中c(H+),原溶液中c(SO42-)=$\frac{1}{2}$c(H+),稀释500倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算出稀释后溶液中硫酸根的物质的量浓度,最后得出比例关系;
C.该温度下,水的离子积常数KW=1×10-12,则纯水pH=6,pH=4的H2SO4溶液中c(H+)=10-4 mol/L,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3 mol/L,混合并保持恒温,混合溶液的pH=7>6,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,据此计算稀硫酸和氢氧化钠溶液体积之比;
D.前者根据溶质的物质的量不变,pH升高了1,则体积是原盐酸体积的10倍;后者pH也升高了1,反应后酸过量,可设碱液体积x,计算氢氧化钠溶液的体积.
解答 解:A.温度T时水的离子积常数为KW,根据c(H+)•c(OH-)=KW,c(H+)=$\frac{{K}_{W}}{c(OH-)}$,浓度为a mol•L-1的一元酸HA与b mol•L-1的一元碱BOH等体积混合,混合溶液中当c(H+)=$\sqrt{{k}_{W}}$ mol•L-1时,说明c(H+)=c(OH-),可判定该溶液呈中性,故A正确;
B.pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-5mol/L=5×10-6mol/L,
溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×$\frac{1}{500}$=1×10-8mol/L,
所以稀释后溶液中c(H+)与c(SO42-)的比值近似为:1×10-7mol/L:1×10-8mol/L=10:1,故B错误;
C.该温度下,水的离子积常数KW=1×10-12,则纯水pH=6,pH=4的H2SO4溶液中c(H+)=10-4 mol/L,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3 mol/L,混合并保持恒温,混合溶液的pH=7>6,溶液呈碱性,则混合溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$mol/L=10-5 mol/L,设稀硫酸、NaOH溶液体积为xL、yL,
c(OH-)=$\frac{1{0}^{-3}y-1{0}^{-4}x}{x+y}$mol/L=10-5 mol/L,x:y=9:1,故C正确;
D.盐酸平均分成2份,设每份都为1L,将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1,反应后酸过量,可设碱液体积x,依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL=10-2mol/L×(1+x)L,解之得x=$\frac{9}{11}$L,则加入的水与NaOH溶液的体积比为9:$\frac{9}{11}$=11:1,故D正确.
故选B.
点评 本题考查pH的计算,综合性强,涉及溶液的稀释和酸碱中和后混合液的pH计算,具有一定的难度,解题的关键是概念清楚,公式准确,在熟练掌握基础知识的同时,还应根据题目的要求,灵活运用,解决实际问题.

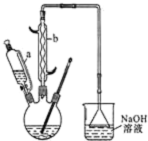 己二酸
己二酸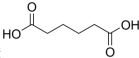 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下,仪器b的名称为球形冷凝管(或冷凝管).
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的NO2气体来不及被碱液吸收而外逸到空气中.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
 ,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).
,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性). | A. | 糖类是具有甜味的物质 | |
| B. | 糖类是人体必需的营养素 | |
| C. | 葡萄糖是一种多羟基醛,不具有还原性 | |
| D. | 糖类是具有Cn(H2O)m通式的物质,糖也称为碳水化合物 |

 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目: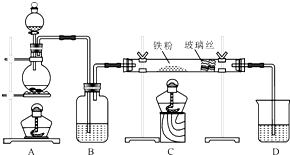 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.