题目内容
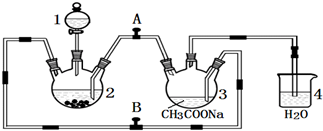
16.CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4•5H2O的实验室制备流程圈.
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),在铜粉溶解时可以观察到的实验现象:产生无色气体与空气变为红棕色、溶液呈蓝色.
(2)根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为2:3.
(3)已知:CuSO4+2NaOH→Cu(OH)2+Na2SO4称取0.1000g提纯后的CuSO4?5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4•5H2O0.098g.
(4)在滴定中,眼睛应注视锥形瓶中溶液颜色变化;滴定终点时,准确读数应该是滴定管上蓝线粗细交界点所对应的刻度.
(5)若上述滴定操作中,滴定管加盐酸之前未进行润洗,则测得试样中所含CuSO4•5H2O的质量偏小(填“偏大”“偏小”或“无影响”).
(6)如果l.040g提纯后的试样中含CuSO4•5H2O的准确值为1.015g,而实验测定结果是1.000g,测定的相对误差为-1.48%.
分析 (1)向含铜粉的稀硫酸中滴加少量浓硝酸,反应生成硫酸铜和NO、水;
(2)根据离子方程式分析计算;
(3)CuSO4和NaOH溶液反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,剩余的NaOH和HCl反应方程式为NaOH+HCl=NaCl+H2O,根据NaOH+HCl=NaCl+H2O计算参加反应的NaOH的物质的量,再根据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4计算硫酸铜的物质的量,根据Cu原子守恒计算胆矾质量;
(4)滴定时要观察锥形瓶中颜色;根据滴定管的正确读数方法解答;
(5)滴定管未润洗,则盐酸的浓度减小,消耗的盐酸的体积偏大,计算出与盐酸反应的NaOH偏多,则与硫酸铜反应的NaOH偏少;
(6)相对误差为相对值除以准确值.
解答 解:(1)Cu与稀硫酸不反应,加入少量浓硝酸后,则溶液中存在稀硝酸,Cu与稀硝酸反应生成NO、硝酸铜、水,NO与氧气反应生成红棕色二氧化氮,所以会看到先生成无色气体,后变为红棕色,溶液变蓝色,
故答案为:产生无色气体与空气变为红棕色、溶液呈蓝色;
(2)向含铜粉的稀硫酸中滴加少量浓硝酸,反应生成硫酸铜和二氧化氮、水,其反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,反应中消耗2molNO3-和8molH+,2mol硝酸提供2mol氢离子,则另外6mol氢离子由硫酸提供,所以需要的硫酸为3mol,则硝酸与硫酸的理论配比(物质的量之比)为2:3,
故答案为:2:3;
(3)CuSO4和NaOH溶液反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,剩余的NaOH和H2SO4反应方程式为NaOH+HCl=NaCl+H2O,
参加该反应的n(NaOH)=n(HCl)=0.1000mol/L×0.02016L=0.002016mol,和CuSO4反应的n(NaOH)=0.1000mol/L×0.028L-0.002016mol=0.000784mol,根据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4知,n(CuSO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.000784mol=0.000392mol,根据Cu原子守恒得n(CuSO4)=n(CuSO4•5H2O)=0.000392mol,胆矾的质量=250g/mol×0.000392mol=0.098g,
故答案为:0.098;
(4)滴定时要观察锥形瓶中颜色变化;在滴定中,准确读数应该是滴定管上蓝线的粗细交界点对应的刻度线,
故答案为:锥形瓶中溶液颜色变化;粗细交界点;
(5)滴定管未润洗,则盐酸的浓度减小,消耗的盐酸的体积偏大,计算出与盐酸反应的NaOH偏多,则与硫酸铜反应的NaOH偏少;而n(CuSO4)=$\frac{1}{2}$n(NaOH),所以计算得到的硫酸铜偏少,即测得试样中所含CuSO4?5H2O的质量偏小,
故答案为:偏小;
(6)相对误差为 $\frac{1.000g-1.015g}{1.015g}$×100%=-1.48%,故答案为:-1.48%.
点评 本题考查了物质含量的测定、实验现象等观察、物质的提纯、中和滴定、实验过程设计及有关计算,注意滴定管的使用,以及相对误差的计算方法,题目难度中等,侧重于考查学生的实验探究能力和计算能力.

 一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
 .
.