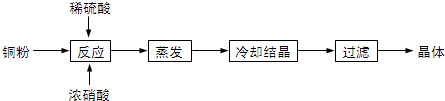
题目内容
1.随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资.工业主要以二氧化钛为原料冶炼金属钛.(1)Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
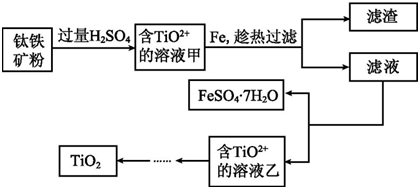
(1)由滤液获得绿矾晶体的操作过程是蒸发、冷却、结晶、过滤.
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有Fe3+、Fe2+.
(3)已知10 kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24 kg,试计算最少加入铁粉的质量.
方法2:TiCl4水解生成TiO2•xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛.
(4)①TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl;
②检验TiO2•xH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净.
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及的步骤如下:TiO2$\stackrel{①}{→}$TiCl4$→_{Mg_{800}℃}^{②}$Ti
反应②的化学方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,该反应成功需要的其他条件及原因是稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
分析 钛铁矿和过量稀硫酸混合,FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+,所以溶液甲中含有Fe2+、TiO2+、Fe3+,然后向溶液中加入Fe,Fe将Fe3+氧化生成Fe2+,然后过滤得到滤渣和滤液,滤液中含有硫酸亚铁,将滤液蒸发浓缩、冷却结晶得到绿矾和含有TiO2+溶液乙,通过一系列反应得到TiO2;
(1)从溶液中获得绿矾晶体,应该采用蒸发浓缩、冷却结晶、过滤的方法;
(2)FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+;
(3)10 kg该钛铁矿中铁元素的质量分数为33.6%,该钛铁矿中Fe元素质量=10kg×33.6%=3.36kg,
绿矾晶体中Fe元素质量=$\frac{22.24×1{0}^{3}g}{278g/mol}×56g/mol$=4.48×103g=4.48kg,根据Fe元素守恒计算;
(4)①TiCl4水解生成TiO2•xH2O,同时生成HCl;
②氯离子用硝酸酸化的硝酸银溶液检验,如果有白色沉淀说明含有氯离子;
Ⅱ.在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应.
解答 解:钛铁矿和过量稀硫酸混合,FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+,所以溶液甲中含有Fe2+、TiO2+、Fe3+,然后向溶液中加入Fe,Fe将Fe3+氧化生成Fe2+,然后过滤得到滤渣和滤液,滤液中含有硫酸亚铁,将滤液蒸发浓缩、冷却结晶得到绿矾和含有TiO2+溶液乙,通过一系列反应得到TiO2;
(1)从溶液中获得绿矾晶体,应该采用蒸发浓缩、冷却结晶、过滤的方法,所以由滤液获得绿矾晶体的操作过程是蒸发、冷却、结晶、过滤,故答案为:蒸发、冷却、结晶、过滤;
(2)FeTiO3和稀硫酸反应生成Fe2+、TiO2+,氧化铁和稀硫酸反应生成Fe3+,所以甲中阳离子为Fe2+、TiO2+、Fe3+,
故答案为:Fe2+、Fe3+;
(3)10 kg该钛铁矿中铁元素的质量分数为33.6%,该钛铁矿中Fe元素质量=10kg×33.6%=3.36kg,
绿矾晶体中Fe元素质量=$\frac{22.24×1{0}^{3}g}{278g/mol}×56g/mol$=4.48×103g=4.48kg,根据Fe元素守恒得需要加入Fe的质量=4.48kg-3.36kg=1.12kg,
答:最少加入Fe的质量为1.12kg;
(4)①TiCl4水解生成TiO2•xH2O,同时生成HCl,反应方程式为TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,
故答案为:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl;
②氯离子用硝酸酸化的硝酸银溶液检验,如果有白色沉淀说明含有氯离子,所以检验TiO2•xH2O中Cl-是否被除净的方法是取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净,
故答案为:取最后一次洗涤液少量,滴加硝酸酸化的AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
Ⅱ.在800℃条件下,四氯化钛和镁反应生成氯化镁和钛,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应.
(5)反应②的化学方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用,所以该反应成功需要的其他条件及原因稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用,
故答案为:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti;稀有气体保护,防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
点评 本题考查物质制备,为高频考点,侧重考查学生分析、判断及知识综合运用能力,明确流程图中发生的反应、分离提纯方法、元素化合物性质是解本题关键,知道氯离子检验方法及现象,注意:氯离子检验时要正确叙述操作方法、实验现象及得出结论,题目难度不大.

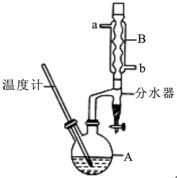 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的温度分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加正丁醇.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上(填“上”或“下”)口倒出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集D(填选项字母)左右的馏分.
A.100℃B.117℃C.135℃D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%(精确到1%).
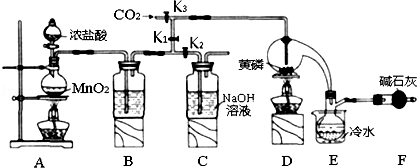
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成P0Cl3,P0Cl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PC13的质量分数为79.75%.
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |
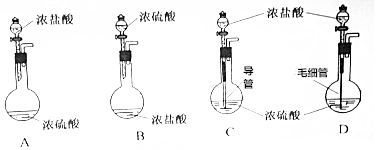
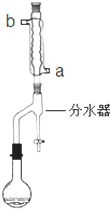 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下: