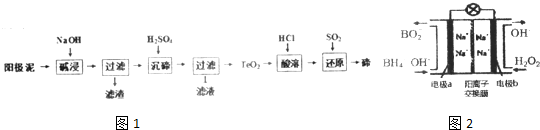
题目内容
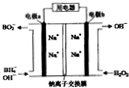 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和解答该题.
解答:
解:A.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故A正确;
B.电极b电极材料为MnO2,H2O2在电极b上得电子发生还原反应,则MnO2电极为正极,同时MnO2是双氧水的分解的催化剂,故B正确;
C.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.正极电极反应式为H2O2+2e-=2OH-,转移6mol电子时,消耗3molH2O2,则电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol,故D错误;
故选D.
B.电极b电极材料为MnO2,H2O2在电极b上得电子发生还原反应,则MnO2电极为正极,同时MnO2是双氧水的分解的催化剂,故B正确;
C.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.正极电极反应式为H2O2+2e-=2OH-,转移6mol电子时,消耗3molH2O2,则电路中通过6.02×1022个电子时,理论上消耗H2O2 0.05mol,故D错误;
故选D.
点评:本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
相关题目
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入1.60g CuO,恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为( )
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
下面列出了用惰性电极电解不同物质的电极反应式,其中错误的是( )
| A、电解CuSO4溶液 阴极:Cu2++2e-═Cu |
| B、电解熔融NaCl 阴极:Na++e-═Na |
| C、电解NaOH溶液 阳极:4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水 阴极:Na++e-═Na |
10g CO和H2组成的混合气体在足量氧气中完全燃烧,立即将全部生成物通入足量的Na2O2中,则固体质量增加( )
| A、10g | B、11.8g |
| C、13.2g | D、无法计算 |
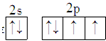 ,它的单质常温时为气态.试用化学符号回答以下问题.
,它的单质常温时为气态.试用化学符号回答以下问题.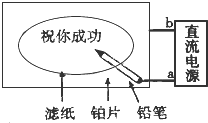 某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列
某学生设计了一个“黑笔写红字”的趣味实验,如图所示.滤纸先用氯化钠、无色酚酞的混合液浸湿,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,回答下列