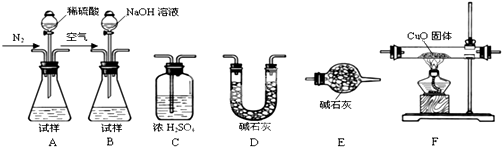
题目内容
(1)1g 硫粉在O2中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式 .
(2)若2.6g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130kJ.则乙炔燃烧的热化学方程式为 .
(2)若2.6g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130kJ.则乙炔燃烧的热化学方程式为
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;
(2)2.6g乙炔的物质的量为0.1mol,0.1mol乙炔完全燃烧放出130kJ热量,则2mol乙炔完全燃烧放出2600kJ热量.
(2)2.6g乙炔的物质的量为0.1mol,0.1mol乙炔完全燃烧放出130kJ热量,则2mol乙炔完全燃烧放出2600kJ热量.
解答:
解:(1)1g硫粉完全燃烧生成二氧化硫气体,放出9.36kJ的热量,所以32g硫粉完全燃烧生成二氧化硫气体,放出299.52kJ的热量,则热化学方程式为:S(s)+O2(g)═SO2(g)△H=-290.52kJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-299.52kJ/mol;
(2)2.6g乙炔的物质的量为0.1mol,0.1mol乙炔完全燃烧放出130kJ热量,则2mol乙炔完全燃烧放出2600kJ热量,所以其热化学反应方程式为2C2H2(g)+5O2(g)═2H2O(l)+4CO2(g)△H=-2600KJ/mol,故答案为:2C2H2(g)+5O2(g)═2H2O(l)+4CO2(g)△H=-2600KJ/mol.
故答案为:S(s)+O2(g)═SO2(g)△H=-299.52kJ/mol;
(2)2.6g乙炔的物质的量为0.1mol,0.1mol乙炔完全燃烧放出130kJ热量,则2mol乙炔完全燃烧放出2600kJ热量,所以其热化学反应方程式为2C2H2(g)+5O2(g)═2H2O(l)+4CO2(g)△H=-2600KJ/mol,故答案为:2C2H2(g)+5O2(g)═2H2O(l)+4CO2(g)△H=-2600KJ/mol.
点评:本题考查了热化学方程式的书写,难度不大,注意掌握热化学方程式的书写规则.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
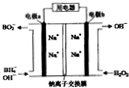 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、2.24L氨气中氨分子数目为0.2NA |
| B、1mol甲基中电子数目为9NA |
| C、1L0.1mol?L-1NaHCO3溶液中氧原子数目为0.3NA |
| D、7.8gNa2O2与足量H2O反应,转移电子数目为0.2NA |
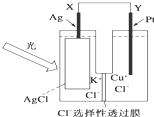 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)