题目内容
4.交通警察执法时常使用的便携式酒精检查仪可能应用了:3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4=3CH3COOH+2Cr2(SO4)3(蓝绿色)+2K2SO4+11H2O这一反应原理,关于该反应,下列说法正确的是( )| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
分析 A.含最高价元素的化合物,不一定具有强氧化性;
B.CH3CH2OH转化为CH3COOH,根据C元素的化合价变化分析;
C.H2SO4中没有化合价的变化;
D.该反应是自发的氧化还原反应,可以设计为原电池.
解答 解:A.含最高价元素的化合物,不一定具有强氧化性,如HCl中H元素为+1价,是最高价,但是HCl没有强氧化性,故A错误;
B.CH3CH2OH转化为CH3COOH,C元素的化合价从-2到0价,1分子CH3CH2OH转移4个电子,则1mol还原剂反应时,转移的电子数为4NA,故B错误;
C.H2SO4中没有化合价的变化,则H2SO4在反应中只表现了酸性,故C错误;
D.该反应是自发的氧化还原反应,可以设计为原电池,当乙醇的浓度越大时,电流越强,所以通过检测电流强度判断司机是否饮酒,故D正确.
故选D.
点评 本题考查了氧化还原反应、原电池原理,题目难度不大,注意从化合价变化的角度分析氧化还原反应,注意把握原电池反应的实质.

练习册系列答案
相关题目
3. 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
15.用NA表示阿伏加德罗常数,下列说法错误的是( )
| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
12.下列离子方程式不正确的是( )
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
19.-种制取粗碘的工艺流程如图所示,下列有关说法错误的是( )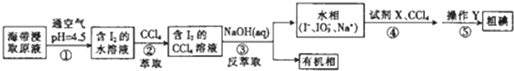

| A. | 步骤②中的萃取过程为物理变化 | |
| B. | 步骤③发生的反应中I2是氧化剂,NaOH是还原剂 | |
| C. | 步骤④所加的试剂X可能是稀硫酸 | |
| D. | 步骤⑤涉及的主要操作Y为分液和蒸馏 |
9.某同学查阅教材上的溶解性表时发现,CuCO3对应的为“-”,表示不存在或遇水就分解.已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水.为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3
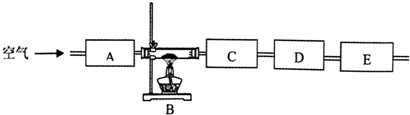
(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
(4)按照该同学的设计思路,只需测定某两个装置的质量变化,即△m (C):△m(D)=9:22时(括号中填写装置的序号)就可确定固体是Cu2(OH)2CO3.
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3

(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
16.禁止运动员使用兴奋剂是2012绿色奥运的重要举措之一,下图是兴奋剂利尿酸的结构 .关于它的说法正确的是( )
.关于它的说法正确的是( )
 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |