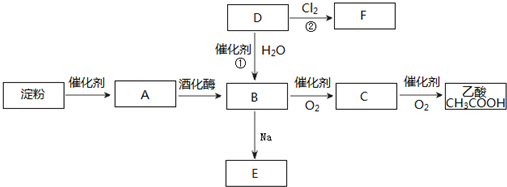
题目内容
9.某同学查阅教材上的溶解性表时发现,CuCO3对应的为“-”,表示不存在或遇水就分解.已知铜离子的常见沉淀为Cu(OH)2(蓝色)、Cu2(OH)2SO4(蓝色)、Cu2(OH)2CO3(绿色)等,它们均不含结晶水.为了探究CuSO4和Na2CO3反应产物的成份,该同学按以下实验方法制备了两种沉淀,并设计了探究沉淀成份的实验.取2个小烧杯和2个锥形瓶,在每个烧杯里加入50mL0.5mol/L的CuSO4溶液,在锥形瓶里分别加入40mL 和50mL0.5mol/LNa2CO3溶液,置于70℃水中水浴加热,然后将CuSO4溶液加入到Na2CO3溶液中,继续水浴,均有气泡产生,几分钟后分别得到蓝绿色和绿色沉淀.过滤、洗涤、干燥,得到两份固体.
I.对蓝绿色沉淀成份的探究.
通过右边实验证实,沉淀中含有Cu2(OH)2CO3和Cu2(OH)2SO4

(1)证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生;
(2)试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生.
II.对绿色沉淀成份的探究
重复I实验,发现没有SO42-存在,有Cu2(OH)2CO3存在;
通过下列实验证实,沉淀中只有Cu2(OH)2CO3
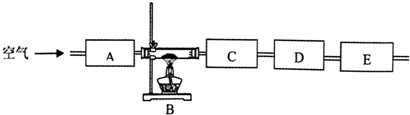
(3)该同学想通过测量固体分解所得气体的质量来确定沉淀的成份,按上述思路组装好装置,加入相应的药品,并指出所加药品的目的.
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
(5)结论:n(Cu2+):n(CO32-)>1时,所得固体产物有Cu2(OH)2CO3和Cu2(OH)2SO4;n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,生成该沉淀发生反应的离子方程式为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
分析 (1)根据Cu2(OH)2CO3与盐酸反应有气泡产生,而Cu2(OH)2SO4与盐酸反应无现象产生分析;
(2)证明有Cu2(OH)2SO4存在即证明硫酸根离子,根据硫酸根与钡离子形成白色沉淀分析;
(3)根据通过测量固体分解所得气体的质量来确定沉淀的成份的实验原理,则开始通除了水蒸气和二氧化碳的空气将绿色固体加热分解的气体全部排到吸收装置中,使测量更准确,又首先应测定所得气体中水蒸气的质量,所以C为浓硫酸,再测定二氧化碳的质量,则D为碱石灰,最后E再用碱石灰目的主要是防止空气中的水蒸气和二氧化碳从后面进入影响测量结果,据此分析;
(4)根据Cu2(OH)2CO3加热分解方程式Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O↑+CO2↑,只要测定水蒸气质量与二氧化碳质量之比等于18:44即可证明固体只有Cu2(OH)2CO3;
(5)根据n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3结合电荷原子守恒书写离子方程式.
解答 解:(1)因为Cu2(OH)2CO3与盐酸反应有气泡产生,而Cu2(OH)2SO4与盐酸反应无现象产生,所以证明有Cu2(OH)2CO3存在的现象为试管2有气泡产生,故答案为:试管2有气泡产生;
(2)证明有Cu2(OH)2SO4存在即证明硫酸根离子,因为硫酸根与钡离子形成白色沉淀,所以试剂①为BaCl2或Ba(NO3)2溶液,证明有Cu2(OH)2SO4存在的现象为试管3有白色沉淀产生,故答案为:BaCl2或Ba(NO3)2溶液;试管3有白色沉淀产生;
(3)根据通过测量固体分解所得气体的质量来确定沉淀的成份的实验原理,则开始通除了水蒸气和二氧化碳的空气将绿色固体加热分解的气体全部排到吸收装置中,使测量更准确,又首先应测定所得气体中水蒸气的质量,所以C为浓硫酸,目的吸收生成的水蒸气,再测定二氧化碳的质量,则D为碱石灰,目的吸收生成的二氧化碳,最后E再用碱石灰目的主要是防止空气中的水蒸气和二氧化碳从后面进入影响测量结果;故答案为:
| 仪器 编号 | 药品 | 目的 |
| A | 除去空气中的水蒸气和二氧化碳 | |
| B | ||
| C | 浓硫酸 | 吸收生成的水蒸气 |
| D | 碱石灰 | 吸收生成的二氧化碳 |
| E | 防止空气中的水蒸气和二氧化碳从后面进入影响测量结果 |
(5)当n(Cu2+):n(CO32-)≤1时,所得固体产物全部是Cu2(OH)2CO3,则根据电荷原子守恒,离子方程式为2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑;故答案为:2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑.
点评 本题主要考查了CuSO4和Na2CO3反应产物的成份的探究,关键是明确反应原理,掌握基础知识是解答的关键,本题难度不大.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 | |
| D. | 将1molCu置于含2molH2SO4的浓溶液中加热 |
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
| A. | 相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O; c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(Y2-)>c(H+)>c (H2Y) |
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
| A. | CH4+Cl2-→CH3Cl+HCI | |
| B. | CH2═CH2+Br2-→CH2BrCH2Br | |
| C. | nCH2═CH2-→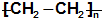 | |
| D. | CH3CH2OH+CH3COOH-→CH3COOCH2CH3+H2O |
| A. | C12H22O11 | B. | SO3 | C. | NaHCO3 | D. | Br2 |