题目内容
16.禁止运动员使用兴奋剂是2012绿色奥运的重要举措之一,下图是兴奋剂利尿酸的结构 .关于它的说法正确的是( )
.关于它的说法正确的是( )| A. | 利尿酸的化学式为:C13H14O4Cl2 | |
| B. | 利尿酸最多可与4 molH2发生反应 | |
| C. | 利尿酸可使溴的四氯化碳溶液褪色 | |
| D. | 利尿酸在一定条件下能发生消去反应 |
分析 由结构简式可知分子式,分子中含碳碳双键、-Cl、C=O及-COOH等,结合烯烃、卤代烃、羧酸的性质来解答.
解答 解:A.由结构简式可知,分子式为C13H12O4Cl2,故A错误;
B.苯环、碳碳双键、羰基均与氢气发生加成反应,则1mol 利尿酸最多可与5 mol H2发生反应,故B错误;
C.含碳碳双键,利尿酸可使溴的四氯化碳溶液褪色,故C正确;
D.-Cl在苯环上,不能发生消去反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酮、苯及卤代烃性质的考查,注意-COOH不能发生加成反应,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
4.交通警察执法时常使用的便携式酒精检查仪可能应用了:3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4=3CH3COOH+2Cr2(SO4)3(蓝绿色)+2K2SO4+11H2O这一反应原理,关于该反应,下列说法正确的是( )
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
11.下列实验方案能达到预期目的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
1. 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
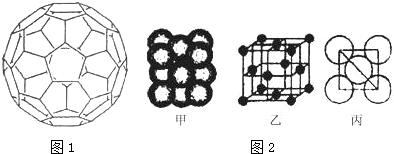
(1)某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)ACl2分子中A的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确否,并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
5.下列说法正确的是( )
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1molOH-与1mol-OH所含质子数均为9NA | |
| B. | 0.1mol/L的CuCl2溶液中含Cl-的数目为0.2 NA | |
| C. | 标准状况下,11.2LCCl4中含C-C键的数目为2NA | |
| D. | 10 mL 2mol/LH2O2完全分解,转移的电子数为0.2 NA |
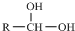 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$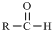 请根据如图回答:
请根据如图回答: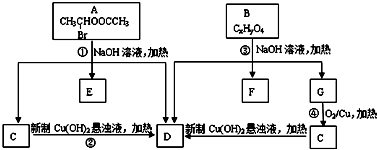
 .
. ;
; .
.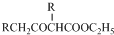 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).