题目内容
15.用NA表示阿伏加德罗常数,下列说法错误的是( )| A. | 25℃时1mL水中含10-10 NA个OH-离子 | |
| B. | 1molCl2通入足量的NaOH溶液中充分反应转移的电子数为2NA | |
| C. | a g某气体含分子数为b,c g该气体在标况下的体积约为22.4bc/(aNA)L | |
| D. | 0.1mol钠和O2在一定条件下反应生成Na2O和Na2O2混合物时,失去电子数为0.1NA |
分析 A、25℃时,纯水中氢氧根的浓度为10-7mol/L;
B、氯气和碱的反应为歧化反应;
C、ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其体积V=$\frac{N}{{N}_{A}}$×Vm;
D、钠反应后变为+1价.
解答 解:A、25℃时,纯水中氢氧根的浓度为10-7mol/L,故1mL水中氢氧根的物质的量为10-10mol,个数为10-10NA个,故A正确;
B、氯气和碱的反应为歧化反应,故1mol氯气转移1mol电子即NA个,故B错误;
C、ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其在标况下的体积V=$\frac{N}{{N}_{A}}$×Vm=$\frac{22.4bc}{a{N}_{A}}$,故C正确;
D、钠反应后变为+1价,故0.1mol钠失去0.1NA个电子,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.下列表达方式错误的是( )
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: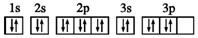 |
3.下列实验操作、现象和解释都正确的是( )
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO制1000℃ | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
20.下列画有横线的反应物在反应中不能完全消耗的是( )
| A. | 将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃 | |
| B. | 向等物质的量的干冰和CaO的混合物中加几滴水 | |
| C. | 在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2 | |
| D. | 将1molCu置于含2molH2SO4的浓溶液中加热 |
4.交通警察执法时常使用的便携式酒精检查仪可能应用了:3CH3CH2OH+2K2Cr2O7(橙色)+8H2SO4=3CH3COOH+2Cr2(SO4)3(蓝绿色)+2K2SO4+11H2O这一反应原理,关于该反应,下列说法正确的是( )
| A. | 该反应证明了,含最高价元素的化合物,一定具有强氧化性 | |
| B. | 1mol还原剂反应时,转移的电子数为2NA | |
| C. | H2SO4在反应中表现了氧化性和酸性 | |
| D. | 可以利用该反应原理,将它设计成原电池,通过检测电流强度判断司机是否饮酒 |
5.下列说法正确的是( )
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
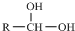 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$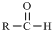 请根据如图回答:
请根据如图回答: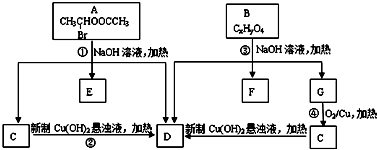
 .
. ;
; .
.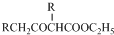 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).