题目内容
2.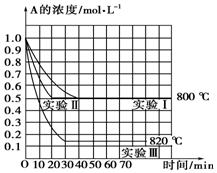 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为0.0125 mol•L-1•min-1.
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是实验Ⅱ使用了催化剂.
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向逆(填“正”或“逆”)反应方向移动,该正反应是吸热(填“放热”或“吸热”)反应.
分析 (1)实验Ⅰ中,反应在0min至40min内A的浓度变化为1mol/L-0.5mol/L=0.5mol/L,再根据v=$\frac{△c}{△t}$计算;
(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快;
(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动.
解答 解:(1)实验Ⅰ中,反应在0min至40min内A的浓度变化为1mol/L-0.5mol/L=0.5mol/L,所以v(A)=$\frac{0.5mol/L}{40min}$=0.0125 mol•L-1•min-1,
故答案为:0.0125mol•L-1•min-1;
(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂,故答案为:实验Ⅱ使用了催化剂;
(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
故答案为:逆;吸热.
点评 本题考查反应速率计算、外界条件对平衡的影响、化学平衡图象等,难度不大,(2)中注意改变压强,平衡不移动,物质的浓度发生变化.

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
7.下列说法中不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 为了防止龋齿,人人都要使用含氟牙膏 | |
| C. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
13.某温度时,在2.0L密闭容器中气体X和气体Y反应生成气体Z,它们的物质的量随时间的变化如表所示:
(1)体系中发生反应的化学方程式是X+2Y?2Z;
(2)列式计算该反应在0~5min内产物Z的平均反应速率:v(Z)=0.07mol/(L•min);
(3)该反应达到平衡时,反应物X的转化率为45%;平衡混合气体中Z的体积分数为58%.
| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
(2)列式计算该反应在0~5min内产物Z的平均反应速率:v(Z)=0.07mol/(L•min);
(3)该反应达到平衡时,反应物X的转化率为45%;平衡混合气体中Z的体积分数为58%.
10.维生素在人体内起到调节新陈代谢,预防疾病,维护身体健康的作用.患坏血症的人缺乏的维生素是( )
| A. | 维生素D | B. | 维生素C | C. | 维生素B | D. | 维生素A |
17.含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42-的物质的量浓度为( )
| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |
7.BaCO3与稀硝酸反应,正确的离子方程式是( )
| A. | Ba2++CO32-+2H+=Ba(NO3)2+H2O+CO2↑ | |
| B. | BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | BaCO3+2H++2NO3-=Ba(NO3)2+H2O+CO2↑ | |
| D. | CO32-+2H+=H2O+CO2↑ |
14.配制一定物质的量浓度的某溶液,下列情况会使溶液浓度偏低的是( )
| A. | 未冷却即转移、定容 | B. | 溶液转移后,未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 容量瓶中原有少量蒸馏水 |
11.下列有关实验的说法正确的是( )
| A. | 在制备乙烯实验中,为防止反应过于剧烈,加热时应使温度缓慢上升至170℃ | |
| B. | 向苯酚钠稀溶液中,不断通入足量二氧化碳气体,溶液最终不会出现浑浊现象 | |
| C. | 将溴乙烷滴入NaOH溶液后加热,待充分反应后,再加入AgNO3溶液后有浅黄色沉淀生成 | |
| D. | 分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,同时在水浴中加热,三支试管中香味持续时间按加入氢氧化钠、稀硫酸、水的顺序依次增长 |
12.实验室欲配制一种仅含有四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol/L,能达到此目的是( )
| A. | Al3+、K+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | B. | Na+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$、K+ | ||
| C. | ClO-、I-、NH${\;}_{4}^{+}$、Ba2+ | D. | Na+、SO${\;}_{4}^{2-}$、Mg2+、Cl- |