题目内容
13.某温度时,在2.0L密闭容器中气体X和气体Y反应生成气体Z,它们的物质的量随时间的变化如表所示:| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
(2)列式计算该反应在0~5min内产物Z的平均反应速率:v(Z)=0.07mol/(L•min);
(3)该反应达到平衡时,反应物X的转化率为45%;平衡混合气体中Z的体积分数为58%.
分析 (1)根据物质参与反应的物质的量之比=化学计量数之比;
(2)根据v=$\frac{△c}{△t}$计算;
(3)根据转化率=$\frac{X的转化量}{X的起始量}$×100%、同温同压下,气体的体积分数=气体的物质的量分数.
解答 解:(1)从图表分析,反应1min内X消耗0.1mol,Y消耗0.2mol,Z生成0.2mol,参与反应的X、Y、Z的物质的量之比为:0.1:0.2:0.2=1:1:2,所以化学方程式为:X+2Y?2Z;
故答案为:X+2Y?2Z;
(2)由图,在0~5min内产物Z的生成0.7mol,则v=$\frac{△c}{△t}$=$\frac{0.7mol÷2L}{5min}$=0.07mol/(L•min);
故答案为:0.07mol/(L•min);
(3)分析图表可知反应在9min到达平衡,此时X为0.55mol,Y为0.10mol,Z为0.90mol,则X的转化率为:$\frac{1.00mol-0.55mol}{1.00mol}$×100%=45%;同温同压下,气体的体积分数=气体的物质的量分数,衡混合气体中Z的体积分数为$\frac{0.90mol}{0.55mol+0.10mol+0.90mol}$×100%=58%,
故答案为:45%;58%(或58.1%).
点评 本题考查了根据物质反应量写化学方程式,化学平衡的判断,化学反应的有关计算,题目较基础.

练习册系列答案
相关题目
18.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |
1.在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.
已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12
Fe3++SCN-?FeSCN2+(红色),K=138,下列说法不正确的是( )
已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12
Fe3++SCN-?FeSCN2+(红色),K=138,下列说法不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | |
| C. | 上述实验采用相同指示剂,可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
18.钛被誉为“太空金属”、“未来金属”.它的强度大、密度小、可塑性好、抗腐蚀性能强.它和它的合金被广泛用于火箭、导弹、航天飞机、船舶、化工和通讯设备中.室温下,它不与水、稀硫酸、稀硝酸反应,但易溶于氢氟酸,推断其原因是( )
| A. | 氟离子易与钛离子形成可溶性难电离物质 | |
| B. | 氢氟酸的氧化性比其他酸强 | |
| C. | 氢氟酸的还原性比其他酸强 | |
| D. | 氢氟酸的酸性比其他酸强 |
5.T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-a kJ•mol-1(a>0),反应过程中测定的数据如表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ | |
| B. | 恒温,如果压缩容器体积,B的浓度和体积分数均不变 | |
| C. | 若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol | |
| D. | 恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大 |
3.下列有关化学实验安全问题的叙述中不正确的是( )
| A. | 少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品 | |
| B. | 氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气 | |
| C. | 浓硝酸需用细口棕色试剂瓶密封保存 | |
| D. | 实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理 |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示: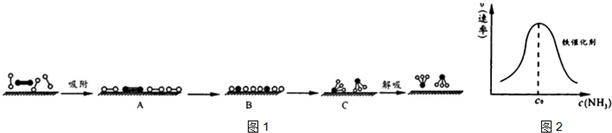
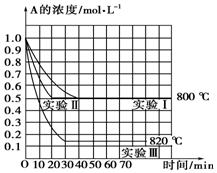 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答: