题目内容
7.BaCO3与稀硝酸反应,正确的离子方程式是( )| A. | Ba2++CO32-+2H+=Ba(NO3)2+H2O+CO2↑ | |
| B. | BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | BaCO3+2H++2NO3-=Ba(NO3)2+H2O+CO2↑ | |
| D. | CO32-+2H+=H2O+CO2↑ |
分析 反应生成硝酸钡、水、二氧化碳,碳酸钡、水、二氧化碳在离子反应中保留化学式,以此来解答.
解答 解:反应生成硝酸钡、水、二氧化碳,离子反应为BaCO3+2H+=Ba2++H2O+CO2↑,故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
18.钛被誉为“太空金属”、“未来金属”.它的强度大、密度小、可塑性好、抗腐蚀性能强.它和它的合金被广泛用于火箭、导弹、航天飞机、船舶、化工和通讯设备中.室温下,它不与水、稀硫酸、稀硝酸反应,但易溶于氢氟酸,推断其原因是( )
| A. | 氟离子易与钛离子形成可溶性难电离物质 | |
| B. | 氢氟酸的氧化性比其他酸强 | |
| C. | 氢氟酸的还原性比其他酸强 | |
| D. | 氢氟酸的酸性比其他酸强 |
15.已知反应mX(g)+nY(g)?qZ(g)△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法不正确的是( )
| A. | 通入稀有气体使压强增大,平衡不移动 | |
| B. | 增大压强同时又升高温度,反应速率加快且可以提高Z 的产率 | |
| C. | 降低温度,混合气体的平均相对分子质量变大 | |
| D. | 增加X的物质的量,Y的转化率增大 |
12.下列各组物质中,可按溶解、过滤、蒸发结晶的操作顺序分离的是( )
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA | |
| C. | 78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA | |
| D. | 标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
16.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
17.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
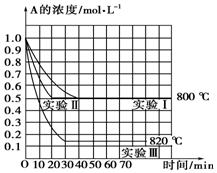 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答: