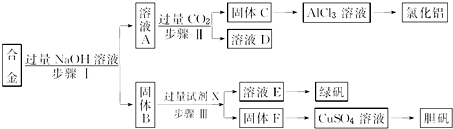
题目内容
10.下表是元素周期表的一部分,请按要求回答有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
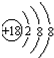 ;
;(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素④与元素⑦形成的化合物中的化学键类型是离子键,写出该化合物的电子式:
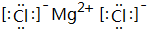 ;
;(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中酸性最弱的是H2CO3(填化学式);
(5)元素③与元素⑩两者核电荷数之差是26;
(6)气态氢化物能与其最高价氧化物对应的水化物反应生成盐的元素是:②(填序号);
(7)④⑤⑥⑦四种元素的简单离子的半径由大到小的顺序为:S2->Cl->Mg2+>Al3+(填化学式).
分析 由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体Ar最不活泼,原子核外有18个电子层,各层电子数为2、8、8;
(2)氢氧化铝是两性氢氧化物,⑨的最高价氧化物对应的水化物为KOH,Al与氢氧化钾反应生成偏铝酸钾与氢气;
(3)元素④与元素⑦形成的化合物为MgCl2,由镁离子与氯离子构成;
(4)非金属性越强,最高价含氧酸的酸性最强;
(5)元素③与元素⑩两者核电荷数之差为第三、第四周期容纳元素种数;
(6)氮元素的气态氢化物能与其最高价氧化物对应的水化物反应生成盐--硝酸铵;
(7)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越大离子半径越大.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)稀有气体Ar最不活泼,原子核外有18个电子层,各层电子数为2、8、8,原子结构示意图为: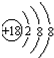 ,
,
故答案为: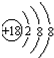 ;
;
(2)A元素的氢氧化物--氢氧化铝是两性氢氧化物,⑨的最高价氧化物对应的水化物为KOH,Al与氢氧化钾反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素④与元素⑦形成的化合物为MgCl2,由镁离子与氯离子构成,含有离子键,电子式为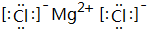 ,
,
故答案为:离子键;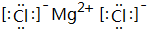 ;
;
(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中高氯酸、硫酸、硝酸均为强酸,而碳酸为弱酸,故碳酸的酸性最弱,
故答案为:H2CO3;
(5)元素③与元素⑩两者核电荷数之差为第三、第四周期容纳元素种数,即原子序数形成8+18=26,
故答案为:26;
(6)氮元素的气态氢化物能与其最高价氧化物对应的水化物反应生成盐--硝酸铵,为表中②号元素,
故答案为:②;
(7)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越大离子半径越大,故离子半径:S2->Cl->Mg2+>Al3+,
故答案为:S2->Cl->Mg2+>Al3+.
点评 本题考查元素周期表与元素周期律综合运用,熟练掌握元素周期律表的结构,从结构上理解元素周期律,注意理解同主族原子序数关系.

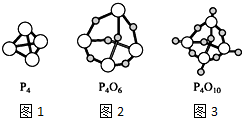 如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )
如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( )| A. | P4O6中的磷原子采用sp2方式杂化 | |
| B. | 三氧化二磷、五氧化二磷这两个名称都表示分子的实际组成 | |
| C. | P4、P4O6和P4O10分子中同一P原子上两个化学键之间的夹角都是60° | |
| D. | P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体 |
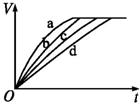 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制的图如图,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | 盐酸的浓度(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4-2-3-1 | B. | 1-2-3-4 z | C. | 3-4-2-1 | D. | 1-2-4-3 |
| A. | 俄国化学家门捷列夫编制了第一张元素周期表 | |
| B. | 周期表中最外层电子数相同的元素都排列在同一列中 | |
| C. | 周期表中一共有18列,但只有16个族 | |
| D. | 随着人们的认识的发展,周期表也在不断的发展变化着 |
| A. | 用NH4Cl溶液蒸干制备NH4Cl固体 | |
| B. | 用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 | |
| C. | 用重结晶法除去KNO3中混有的NaCl | |
| D. | 将混有少量氯化氢气体的Cl2通入NaOH溶液中除去氯化氢气体 |
| A. | 宇宙飞船中使用的碳纤维,是一种新型无机非金属材料 | |
| B. | 不可用铝制餐具长时间存放酸性、碱性食物 | |
| C. | 明矾可用于净水,氢氧化铝常用于治疗胃病 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
 .
.