题目内容
1.下列说法不正确的是( )| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
分析 A.二甲苯存在邻、间、对三种;二甲苯与四甲苯的苯环上存在等效的H原子;
B.1-丙醇中含4种H,2-丙醇中含3种H;
C.水解后在酸性溶液中检验溴离子;
D.油脂不是高分子.
解答 解:A.二甲苯存在邻、间、对三种;二甲苯与四甲苯的苯环上存在等效的H原子,则二甲苯和四甲苯均有三种,故A正确;
B.1-丙醇中含4种H,2-丙醇中含3种H,则利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇,故B正确;
C.水解后在酸性溶液中检验溴离子,则溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子,故C正确;
D.油脂不是高分子,油脂皂化反应中不存在大分子,只有石油裂解是由高分子物质生成小分子物质的过程,故D错误;
故选D.
点评 本题考查有机物的鉴别及检验,为高频考点,把握物质的性质、有机物的组成及结构等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.有下列四组物质,如果把该组某组物质中的后者逐滴加入到前者中至过量,将出现“先产生白色沉淀,白色沉淀质量达到最大值后不溶解”的现象,这组物质是( )
| A. | 硝酸银、氨水 | B. | 硫酸亚铁溶液、氢氧化钠溶液 | ||
| C. | 明矾溶液、氢氧化钡溶液 | D. | 氯化铝溶液、氢氧化钠溶液 |
9.原理Cr2O72-+CH3CH2OH+H++H2O→[Cr(H2O)6]3++CH3COOH(未配平)可用于检测司机是否酒后驾驶,下列说法正确的是( )
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
16.某基态原子的3d能级上有一个电子,其N层上的电子数为( )
| A. | 0 | B. | 2 | C. | 3 | D. | 8 |
6.S2Cl2是工业上常用的硫化剂,是一种金黄色液体.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量Cl2制取S2Cl2的装置(部分夹持、加热装置已略去)
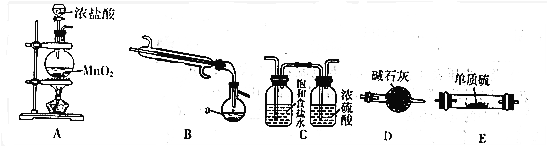
(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
13.室温下,下列溶液等体积混合后pH一定大于7的是( )
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
10.市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大.回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
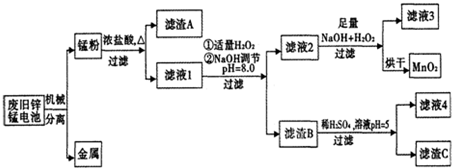
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如表:
(1)加入NaOH溶液调节pH=8.0,目的是使Fe3+、Zn2+完全沉淀而除去;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=1.0×10-17.
(2)滤液1中加入H2O2的作用是Fe2+全部氧化为Fe3+
(3)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(5)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(6)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液阳极电极反应式为2MnO42--2e-=2MnO4-.

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)滤液1中加入H2O2的作用是Fe2+全部氧化为Fe3+
(3)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(5)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(6)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液阳极电极反应式为2MnO42--2e-=2MnO4-.
11.把5molA和6molB的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)?6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1mol•L-1•min-1.下列计算结果正确的是( )
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |