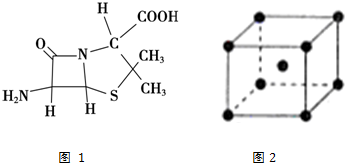
题目内容
18.甲、乙两种金属:①甲比乙容易与H2O反应;②甲单质能与乙的阳离子发生置换反应;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某非金属反应时,甲原子失去的电子数目比乙多;⑤甲与乙作为电极材料,盐酸做电解质溶液构成原电池,甲为正极.能说明甲比乙的金属性强的是( )| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
分析 比较金属性的强弱,可根据①金属活动顺序表,②最高价氧化物对应水化物的碱性强弱,③与水、酸反应的剧烈程度,④单质之间的置换反应⑤原电池中负极材料活泼性强等.
解答 解:①甲比乙容易与H2O反应,说明甲比乙的金属性强,故正确;
②甲单质能与乙的阳离子发生置换反应,说明甲比乙的金属性强,故正确;
③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强,所以金属性甲比乙强,故正确;
④金属性强弱与失电子的多少无关,故错误;
⑤甲与乙作为电极材料,盐酸做电解质溶液构成原电池,活泼金属为负极,故错误;
故选C.
点评 本题考查金属的活泼性的比较,题目难度不大,比较金属活泼性的角度很多,注意基础知识的积累.

练习册系列答案
相关题目
9.往氯水中滴入Na2SO3溶液的pH变化如图所示,下列说法正确的是( )
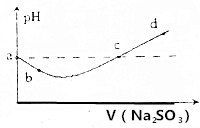

| A. | a点表示的溶液中存在3种分子,3种离子 | |
| B. | b点溶液中不存在SO2 | |
| C. | c点溶液中c(Na+)=2c(HSO3-)+2c(SO32-) | |
| D. | d点溶液中不存在HSO3- |
9.原理Cr2O72-+CH3CH2OH+H++H2O→[Cr(H2O)6]3++CH3COOH(未配平)可用于检测司机是否酒后驾驶,下列说法正确的是( )
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
6.S2Cl2是工业上常用的硫化剂,是一种金黄色液体.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
如图是实验室中通过向熔融的单质硫中通入少量Cl2制取S2Cl2的装置(部分夹持、加热装置已略去)
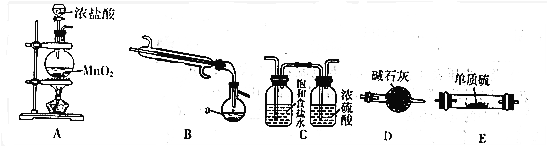
(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
已知:①S2Cl2不稳定,进一步氧化可得SCl2
②S2Cl2和SCl2 都与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+64HCl
③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2时,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验验证所得产品中是否含有杂质SCl2:取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
13.室温下,下列溶液等体积混合后pH一定大于7的是( )
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
3.短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和.下列说法正确的是( )
| A. | 原子半径C>D>E,三者形成的简单离子中D离子的半径最小 | |
| B. | 元素A所形成的氢化物常温下一定为气态 | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
10.市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大.回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
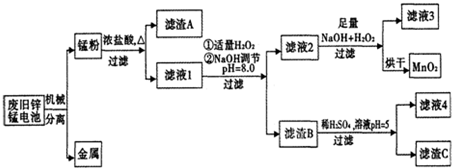
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如表:
(1)加入NaOH溶液调节pH=8.0,目的是使Fe3+、Zn2+完全沉淀而除去;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=1.0×10-17.
(2)滤液1中加入H2O2的作用是Fe2+全部氧化为Fe3+
(3)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(5)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(6)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液阳极电极反应式为2MnO42--2e-=2MnO4-.

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)滤液1中加入H2O2的作用是Fe2+全部氧化为Fe3+
(3)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(5)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(6)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液阳极电极反应式为2MnO42--2e-=2MnO4-.
8.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |