题目内容
17.下列各组大小关系比较中错误的( )| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
分析 A.碳酸氢钠加热分解生成碳酸钠;
B.二氧化碳与NaClO反应生成HClO;
C.硝酸浓度越大,氧化性越强;
D.Al3+先与碱反应,然后NH4+再与碱反应.
解答 解:A.碳酸氢钠加热分解生成碳酸钠,则热稳定性:Na2CO3>NaHCO3,故A正确;
B.二氧化碳与NaClO反应生成HClO,发生强酸制取弱酸的反应,则酸性:H2CO3>HClO,故B正确;
C.硝酸浓度越大,氧化性越强,则氧化性:浓硝酸>稀硝酸,故C正确;
D.含NH4+、Al3+的混合溶液中Al3+先与碱反应,然后NH4+再与碱反应,则结合OH-的能力:NH4+<Al3+,故D错误;
故选D.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
7.工业利用NaOH溶液或氨水喷淋捕捉空气中的CO2制造甲醇,流程图如图1所示:
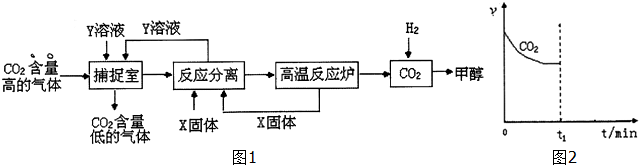
(1)下列有关捕捉空气中的CO2过程中的叙述不正确的有BD.
A、X选用CaO,而且要循环利用CaO与Y溶液
B、捕捉室里温度越高越有利于CO2 的捕捉
C、开放高效光催化剂分解水制氢气,是降低合成甲醇成本的有效途径
D、该捕捉CO2技术的应用有利于缓解全球变暖,而且能耗小
(2)在捕捉室用稀氨水喷淋“捕捉”空气中的CO2时,有NH2COONH4(氨基甲酸胺)生成.现将一定量纯净的氨基甲酸胺置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应
NH2COONH4(s)?2NH3(g)+CO2(g)达到分解平衡.实验测得不同温度及反应时间(t1<t2<t3)的有关表:氨基甲酸铵分解时温度、气体总浓度及反应时间的关系
①氨基甲酸胺分解反应为吸热反应(选填“吸热”、“放热”).在25℃,0-t1时间内产生氨气的平均速率为:$\frac{1.8}{{t}_{1}}$×10-3mol/(L.min).
②根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)?NH2COONH4(s)平衡常数K约为4.9×108.
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.
①将1mol CO2和3mol H2充入恒温恒压的密闭容器中发生上述反应,CO2消耗速率v(CO2)与时间关系如图2所示.若在时间t1时,向容器中再充入1mol CO2和3mol H2,请在图中画出CH3OH生成速率v(CH3OH)与时间的关系曲线.
②在一个恒温固定容积的密闭容器中,加入1mol CO2和3mol H2,充分反应后达到平衡放出热量为aKJ.若在原来的容器中加入2mol CO2和6mol H2,在相同温度下充分反应,达到平衡放出热量为bKJ.则a和b满足的关系b>2a.

(1)下列有关捕捉空气中的CO2过程中的叙述不正确的有BD.
A、X选用CaO,而且要循环利用CaO与Y溶液
B、捕捉室里温度越高越有利于CO2 的捕捉
C、开放高效光催化剂分解水制氢气,是降低合成甲醇成本的有效途径
D、该捕捉CO2技术的应用有利于缓解全球变暖,而且能耗小
(2)在捕捉室用稀氨水喷淋“捕捉”空气中的CO2时,有NH2COONH4(氨基甲酸胺)生成.现将一定量纯净的氨基甲酸胺置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应
NH2COONH4(s)?2NH3(g)+CO2(g)达到分解平衡.实验测得不同温度及反应时间(t1<t2<t3)的有关表:氨基甲酸铵分解时温度、气体总浓度及反应时间的关系
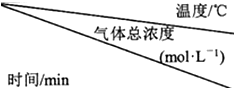 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
②根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)?NH2COONH4(s)平衡常数K约为4.9×108.
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H<0.
①将1mol CO2和3mol H2充入恒温恒压的密闭容器中发生上述反应,CO2消耗速率v(CO2)与时间关系如图2所示.若在时间t1时,向容器中再充入1mol CO2和3mol H2,请在图中画出CH3OH生成速率v(CH3OH)与时间的关系曲线.
②在一个恒温固定容积的密闭容器中,加入1mol CO2和3mol H2,充分反应后达到平衡放出热量为aKJ.若在原来的容器中加入2mol CO2和6mol H2,在相同温度下充分反应,达到平衡放出热量为bKJ.则a和b满足的关系b>2a.
8.于谦的《石灰吟》赞颂了石灰石(碳酸钙)“粉骨碎身浑不怕,要留清白在人间”的品格.碳酸钙属于( )
| A. | 碱 | B. | 氧化物 | C. | 酸 | D. | 盐 |
12.可以用离子方程式Fe3++3OH-=Fe(OH)3↓来表示的化学反应是( )
| A. | Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓ | |
| B. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl | |
| C. | Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓ | |
| D. | FeCl2+2KOH=Fe(OH)2↓+2KCl |
2.下列物质化学性质的说法正确的是( )
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
6.某微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述中正确的是( )
| A. | 所含质子数=A-n | B. | 质子数=Z+A | C. | 所含电子数=Z+n | D. | 所含中子数=A-Z |
7.下列说法正确的是( )
| A. | 只用溴水一种试剂就可鉴别乙烯、乙醇、四氯化碳四种物 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入NaOH溶液,振荡、静置后,分液 | |
| D. | 提取溶解在水中的少量碘:加入乙醇,振荡、静置分层后,取出有机层再分 |
