题目内容
5.一定质量的盐FeSO4•(NH4)2SO4•6H2O,经测定含0.2mol SO42-,那么其中含结晶水0.6mol,含Fe2+0.1mol,该盐0.1mol,其质量为39.2g.分析 FeSO4•(NH4)2SO4•6H2O为强电解质,1molFeSO4•(NH4)2SO4•6H2O含有6mol结晶水,完全电离生成2mol硫酸根离子,1mol二价铁离子,M(FeSO4•(NH4)2SO4•6H2O)=392g/mol,结合m=nM计算解答.
解答 解:FeSO4•(NH4)2SO4•6H2O为强电解质,1molFeSO4•(NH4)2SO4•6H2O含有6mol结晶水,完全电离生成2mol硫酸根离子,则一定质量的盐FeSO4•(NH4)2SO4•6H2O,经测定含0.2mol SO42-,该盐的物质量为0.1mol,含有0.6mol结晶水,0.1mol二价铁离子,质量m=nM=0.1mol×392g/mol=39.2g;
故答案为:0.6;0.1;0.1;39.2.
点评 本题考查了有关物质的量的计算,明确FeSO4•(NH4)2SO4•6H2O的组成,熟悉以物质的量为核心的计算公式是解题 关键,题目难度不大.

练习册系列答案
相关题目
13.若某氧原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氧元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该氧原子的摩尔质量是aNAg | |
| C. | Wg该氧原子的物质的量是$\frac{W}{{(a•N}_{A})mol}$ | |
| D. | Wg该氧原子所含质子数是$\frac{16W}{a}$ |
20.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,则w克这种元素的原子核内中子的物质的量为( )
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
17.下列各组大小关系比较中错误的( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
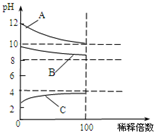
15.下列关于有机物 的说法中不正确的是( )
的说法中不正确的是( )
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 不能发生消去反应 | |
| B. | 所有的碳原子在同一个平面上 | |
| C. | 能够发生加成反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH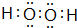
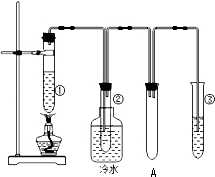 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已忽略).在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水. B.
B.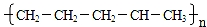
 D.
D.