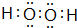题目内容
8.于谦的《石灰吟》赞颂了石灰石(碳酸钙)“粉骨碎身浑不怕,要留清白在人间”的品格.碳酸钙属于( )| A. | 碱 | B. | 氧化物 | C. | 酸 | D. | 盐 |
分析 A.水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱;
B.两种元素组成其中一种为氧元素的化合物为氧化物;
C.水溶液中电离出的阳离子全部是氢离子的化合物为酸;
D.金属阳离子和酸根阴离子构成的化合物为盐;
解答 解:根据碳酸钙中构成微粒及微粒间的作用力分析,碳酸钙是钙离子和碳酸根离子构成的化合物,属于盐,
故选D.
点评 本题考查了物质的分类、组成等,属于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
18.W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
(1)Y在周期表中的位置为第二周期第IVA族,Q的元素名称为氯;
(2)X元素的最高价氧化物的电子式为 ;
;
(3)元素的非金属性:M<Q(填“>”、“<”或“=”),写出一个证明此结论的化学方程式H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核10个电子离子的电子式为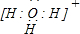 ;
;
(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
| X | ||
| M |
(2)X元素的最高价氧化物的电子式为
 ;
;(3)元素的非金属性:M<Q(填“>”、“<”或“=”),写出一个证明此结论的化学方程式H2S+Cl2=2S↓+2HCl;
(4)Z与W形成的4核10个电子离子的电子式为
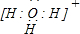 ;
;(5)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
19.碳酸锂是重要的锂化合物,是制备其它高纯锂化合物的重要原料.我国锂资源储量非常丰富,其中卤水锂资源约占其中的79%,由盐湖卤水(主要含有:LiCl、MgCl2、Na2B4O7等) 制备碳酸锂,其工艺流程如下:
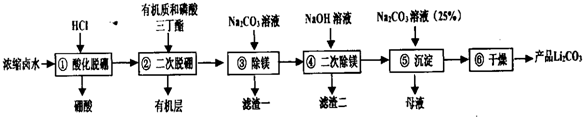
己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
(1)写出①过程的离子方程式B4O72-+2H++5H2O=4H3BO3↓.
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.

己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.
3.25℃时,下列无色溶液中由水电离产生的H+是1×10-5mol/L的且能大量共存的是( )
| A. | K+、Na+、NO3-、SO42- | B. | Mg2+、K+、NO3-、Cl- | ||
| C. | Na+、Fe2+、NO3-、Cl- | D. | Ba2+、H+、Cl-、SO42- |
13.若某氧原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氧元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该氧原子的摩尔质量是aNAg | |
| C. | Wg该氧原子的物质的量是$\frac{W}{{(a•N}_{A})mol}$ | |
| D. | Wg该氧原子所含质子数是$\frac{16W}{a}$ |
20.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,则w克这种元素的原子核内中子的物质的量为( )
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
17.下列各组大小关系比较中错误的( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
18.在标准状况下,与11.2LN2的分子数目相同CO的物质的量是( )
| A. | 0.2 mol | B. | 0.5mol | C. | 1mol | D. | 2mol |