题目内容
7.下列说法正确的是( )| A. | 只用溴水一种试剂就可鉴别乙烯、乙醇、四氯化碳四种物 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入NaOH溶液,振荡、静置后,分液 | |
| D. | 提取溶解在水中的少量碘:加入乙醇,振荡、静置分层后,取出有机层再分 |
分析 A.乙烯与溴水发生加成反应,乙醇与溴水不分层,四氯化碳与溴水分层后有机层在下层;
B.需要浓硫酸作催化剂、吸水剂;
C.二者均与NaOH反应;
D.乙醇与水互溶,不能作催化剂.
解答 解:A.乙烯与溴水发生加成反应,乙醇与溴水不分层,四氯化碳与溴水分层后有机层在下层,现象不同,溴水可鉴别,故A正确;
B.需要浓硫酸作催化剂、吸水剂,则将乙醇、浓硫酸迅速加热到170℃可制得乙烯,故B错误;
C.二者均与NaOH反应,不能除杂,应加饱和碳酸钠溶液、振荡、静置后,分液,故C错误;
D.乙醇与水互溶,不能作催化剂,应选苯或四氯化碳振荡、静置分层后,取出有机层再分,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握性质、现象、混合物分离提纯等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
17.下列各组大小关系比较中错误的( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
18.在标准状况下,与11.2LN2的分子数目相同CO的物质的量是( )
| A. | 0.2 mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
15.下列关于有机物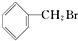 的说法中不正确的是( )
的说法中不正确的是( )
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 不能发生消去反应 | |
| B. | 所有的碳原子在同一个平面上 | |
| C. | 能够发生加成反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
2.有机物C4H9Cl有多少种同分异构体( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
 .
.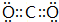 .
. .
.