题目内容
15.重水(2H2O)是重要的核工业原料,下列说法不正确的是( )| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
分析 A.根据核组成符合判断;
B.具有一定数目质子和一定数目中子的一种原子称为核素;
C.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20;
D.具有相同质子数,不同中子数的同一元素的不同核素互为同位素同位素.
解答 解:A.核组成符合左下方数字为质子数,故氘质子数为1,故A正确;
B.具有一定数目质子和一定数目中子的一种原子称为核素,1H与2H质子数相同,中子数不同,是氢元素的不同的核素,故B正确;
C.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,故C正确,
D.1H2O与2H2O为分子,不能称之为同位素,故D错误,
故选D.
点评 本题考查核素、同位素及质子数质子数和质量数关系,把握相关的概念及核变化为解答的关键,选项C为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
3.原子序数依次增大的A、B、C、D、E五种前20号的主族元素,其中A和C、B和D分别在同一主族,且它们原子的最外层电子数之和为20.已知A的氧化物能引起温室效应,E的单质能与水剧烈反应且同主族中存在金属和非金属元素,下列说法正确的是( )
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
10.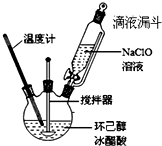 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
反应原理: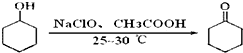
步骤:
①在如如图所示装置中,加入环己醇5.2mL(0.05mol)和冰醋酸33mL,开动电动搅拌器,将NaClO溶液缓慢滴加到反应液中,反应液温度保持在25~30℃,边加边反应,直至用KI淀粉试纸检验呈蓝色.
②一段时间后,反应液中加入足量饱和NaHSO3溶液,并将其转入250mL蒸馏烧瓶中,加入3g AlCl3和几粒沸石,摇匀.加热蒸馏至无油珠滴出为止.
③取馏出液,加入无水碳酸钠,至刚好呈碱性.继续搅拌,加入NaCl固体至不再溶解,分液取有机相.
④向有机相中加入无水硫酸镁,转入50mL蒸馏烧瓶中,馏取155.6℃左右的组分.得2.94g纯净的环己酮.
回答下列问题:
(1)该反应是放热反应,为防止温度过高可以采用的方法有控制滴加速度、冰水浴等.(任写一条)
(2)氧化法制备环己酮起氧化作用的是次氯酸,请写出NaClO和CH3COOH反应生成次氯酸的离子方程式:ClO-+CH3COOH=HClO+CH3COO-.
(3)加入饱和NaHSO3溶液的作用是除去过量的NaClO.加入NaCl固体的作用是减小环己酮的溶解度.分液时用到的玻璃仪器有分液漏斗、烧杯.
(4)蒸馏时加入AlCl3固体的作用是防起泡,加入沸石的作用是防止暴沸.上述实验中使用到滴液漏斗,相比于分液漏斗,它的优点是可以使漏斗内液体顺利流下.
(5)计算本实验的产率60%.
(6)第②步中,设计实验证明:加入的饱和NaHSO3溶液已经足量.取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量.
 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.反应原理:
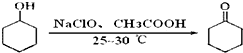
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
①在如如图所示装置中,加入环己醇5.2mL(0.05mol)和冰醋酸33mL,开动电动搅拌器,将NaClO溶液缓慢滴加到反应液中,反应液温度保持在25~30℃,边加边反应,直至用KI淀粉试纸检验呈蓝色.
②一段时间后,反应液中加入足量饱和NaHSO3溶液,并将其转入250mL蒸馏烧瓶中,加入3g AlCl3和几粒沸石,摇匀.加热蒸馏至无油珠滴出为止.
③取馏出液,加入无水碳酸钠,至刚好呈碱性.继续搅拌,加入NaCl固体至不再溶解,分液取有机相.
④向有机相中加入无水硫酸镁,转入50mL蒸馏烧瓶中,馏取155.6℃左右的组分.得2.94g纯净的环己酮.
回答下列问题:
(1)该反应是放热反应,为防止温度过高可以采用的方法有控制滴加速度、冰水浴等.(任写一条)
(2)氧化法制备环己酮起氧化作用的是次氯酸,请写出NaClO和CH3COOH反应生成次氯酸的离子方程式:ClO-+CH3COOH=HClO+CH3COO-.
(3)加入饱和NaHSO3溶液的作用是除去过量的NaClO.加入NaCl固体的作用是减小环己酮的溶解度.分液时用到的玻璃仪器有分液漏斗、烧杯.
(4)蒸馏时加入AlCl3固体的作用是防起泡,加入沸石的作用是防止暴沸.上述实验中使用到滴液漏斗,相比于分液漏斗,它的优点是可以使漏斗内液体顺利流下.
(5)计算本实验的产率60%.
(6)第②步中,设计实验证明:加入的饱和NaHSO3溶液已经足量.取一段KI淀粉试纸于表面皿上,用玻璃棒蘸取反应液点试纸中央,若不变蓝,则NaHSO3溶液已足量.
20.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( )

| A. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| B. | Z位于元素周期表中第二周期,第ⅥA族 | |
| C. | X的气态氢化物的稳定性比Z的弱 | |
| D. | M的原子半径比Y的原子半径大 |
7.合成氨是工业上的重要反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g),下列说法不正确的是( )
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
4.下列有关说法正确的是( )
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
5.某有机物A用质谱仪测定示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )


| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
