题目内容
15.在体积均为1L,pH均等于2的盐酸和醋酸中,分别投入0.005mol镁粉充分反应后,图中比较符合反应事实的曲线是( )| A. |  | B. |  | ||
| C. | 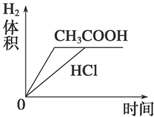 | D. | 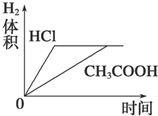 |
分析 HCl是强电解质,在水溶液中完全电离,CH3COOH是弱电解质,在水溶液中部分电离,所以pH相同的盐酸和CH3COOH,c(CH3COOH)>c(HCl),等体积等pH的醋酸和盐酸中n(CH3COOH)>n(HCl)=0.01mol/L×1L=0.01mol,Mg完全反应需要n(HCl)=$\frac{0.005mol×2}{1}$=0.01mol,所以HCl恰好完全反应,醋酸有剩余;
反应速率与氢离子浓度成正比,氢离子浓度越大,其反应速率越大,据此分析解答.
解答 解:HCl是强电解质,在水溶液中完全电离,CH3COOH是弱电解质,在水溶液中部分电离,所以pH相同的盐酸和CH3COOH,c(CH3COOH)>c(HCl),等体积等pH的醋酸和盐酸中n(CH3COOH)>n(HCl)=0.01mol/L×1L=0.01mol,Mg完全反应需要n(HCl)=$\frac{0.005mol×2}{1}$=0.01mol,所以HCl恰好完全反应,醋酸有剩余;
A.因为醋酸有剩余,盐酸恰好完全反应,所以反应后的溶液pH醋酸<盐酸,故A错误;
B.开始时两种溶液中氢离子浓度相等,所以其反应速率相等;反应过程中,醋酸继续电离出氢离子,导致醋酸溶液中氢离子浓度大于盐酸,所以醋酸反应速率大于盐酸,故B错误;
C.因为醋酸有剩余、盐酸恰好完全反应,与两种酸反应的Mg质量相同,所以生成氢气的体积相同,因为醋酸反应速率大,所以完全反应时醋酸反应的时间短,故C正确;
D.根据C知,图象D错误,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生图象分析及计算能力,明确弱电解质电离特点及物质之间的关系是解本题关键,注意B中反应速率与氢离子浓度有关,与电解质强弱无关,题目难度不大.

| A. | NaOH | B. | NaCl | C. | HCl | D. | Ca(ClO)2 |
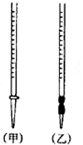 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
| A. | 称取4.77g Na2CO3固体溶于水配成450mL溶液 | |
| B. | 称取5.3g Na2CO3固体溶于水配成500mL溶液 | |
| C. | 称取12.9g Na2CO3•10H2O 固体溶于水配成450mL溶液 | |
| D. | 量取90mL 0.5mol/L Na2CO3溶液加360mL水稀释 |
| A. | 2-丁醇 | B. | 2-甲基-2丙醇 | C. | 甲醇 | D. | 2-甲基-2-丁醇 |
 ol
ol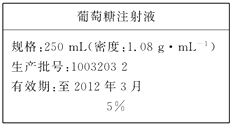 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.